《中国介入影像与治疗学》2021年第18卷第2期
析因设计动物实验筛选聚桂醇硬化治疗肝囊肿最佳方案
骆 晨,周 军* ,付 雪,李智博,覃艳丽,韦 力
(三峡大学第一临床医学院宜昌市中心人民医院超声科,湖北宜昌443003)
摘要:
目的:探讨聚桂醇在体硬化治疗肝囊肿兔模型的最佳药物浓度与作用时间组合方案。
方法:采用两因素三水平析因设计方法,将54只兔结扎胆囊管建成肝囊肿模型,并随机分为9组,每组6只,分别给予0.25%、0.50%及1.00%聚桂醇作用5、10及20min。测量硬化治疗前及治疗后1周胆囊最大横径,评估硬化治疗效果;采用HE染色观察各组胆囊组织病理学变化。
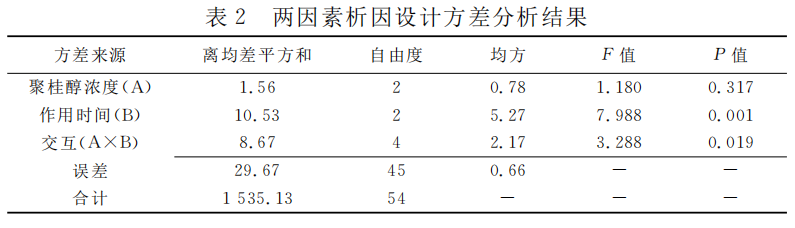
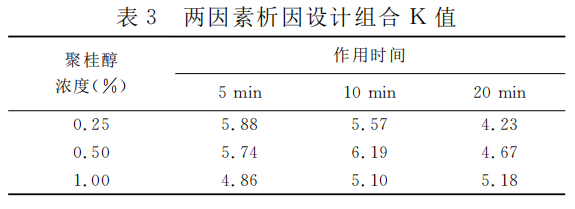
结果:硬化治疗后1周,各组胆囊体积均缩小,囊壁全层均有不同程度变性坏死。以各组治疗后胆囊最大横径作为评价指标进行析因设计,结果显示聚桂醇浓度与作用时间对治疗效果存在交互影响(P=0.019)。两因素析因设计组合中,0.50%聚桂醇浓度作用10min时K值最大(6.19)。
结论:聚桂醇在体硬化治疗肝囊肿兔模型的最佳药物浓度与作用时间组合方案为0.50%、10min。
关键词:
肝囊肿;聚桂醇;硬化治疗;析因设计;兔
聚桂醇是疗效好且安全性高的硬化剂[1-2],可用于有效治疗静脉曲张等血管类疾病[3];随着微创治疗的普及和对药物本身作用机制的探索,其临床应用范围逐渐扩展。介入技术的引入为应用聚桂醇拓宽了途径,并在囊肿性疾病中展示出独特优势。肝囊肿与胆囊壁具有共同的胚胎组织来源、囊壁上皮细胞及分泌特点,故既往常选取兔胆囊进行实验研究[4-5]。在前期研究[6]基础上,本研究以兔胆囊模拟肝囊肿,通过析因设计筛选聚桂醇在体硬化治疗肝囊肿兔模型的最佳药物浓度与作用时间组合方案。
一、资料与方法
1.1 动物实验
2~3月龄新西兰大白兔58只,雌雄不限,体质量(1.99±0.18)kg,购自湖北逸挚诚生物科技有限公司,动物质量合格证编号:42817300000548;饲养于三峡大学动物实验中心,动物许可证编号:SYXK(鄂)2017-0061。饲养条件:室温22℃,12h昼夜交替,自由饮食饲养1周。
1.2 仪器与方法
1.2.1 制备肝囊肿在体模型
以10%水合氯醛麻醉实验兔并常规保定后,于右上腹肋缘下作长约7~8cm斜切口,充分暴露肝脏及胆囊。观察胆囊管与胆囊血管的解剖关系,结扎胆囊管(避开胆囊动、静脉),测量胆囊最大横径,之后抽尽胆汁记录胆囊容积。58只兔造模过程中死亡1只,3只因血管变异结扎失败导致胆囊缺血坏死被排除,最终54只造模成功(图1)。
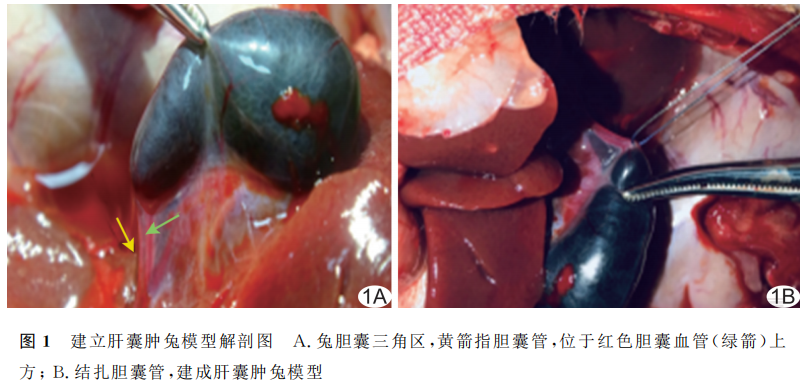
1.2.2 分组及硬化治疗
采用两因素三水平析因设计方法,将54只造模成功兔随机分为9组,每组6只,以0.25%、0.50%、1.00%聚桂醇分别作用5、10、20min。具体方法:根据分组原则,分别给予兔相应浓度聚桂醇,使胆囊呈充盈状态;达到对应作用时间后抽出硬化剂,旷置胆囊,并以生理盐水冲洗腹腔,用无菌纱布吸尽盐水,之后用3-0非吸收性缝线逐层关闭腹腔。继续标准条件下饲养1周。
1.3 相关指标观察
1周后以空气栓塞法处死实验兔,沿原手术切口再次打开腹腔,测量胆囊最大横径,评估硬化效果。取出胆囊,剪去周围肝脏组织,观察胆囊大小、颜色、硬度及血管网等一般情况。以10%甲醛溶液固定胆囊组织,行脱水、石蜡包埋,制成切片用于HE染色。光镜下观察各组胆囊壁全层切片病理改变及各层组织破坏程度。
1.4 统计学分析
采用SPSS19.0统计分析软件。计量资料以图片表示。以单因素方差分析比较各组动物体质量、胆囊最大横径及胆囊容积。采用两因素析因设计方差分析,按照正交实验有交互作用两因素最优水平取决于其交互作用最优水平的原则[7],计算聚桂醇浓度与作用时间不同水平组合时交互作用的K值,确定两因素交互最优水平。P<0.05为差异有统计学意义。
二、结果
2.1 各组一般资料比较
各组兔硬化治疗前体质量、胆囊最大横径及胆囊容积差异均无统计学意义(P均>0.05),治疗后1周胆囊最大横径差异有统计学意义(P=0.033)。见表1。
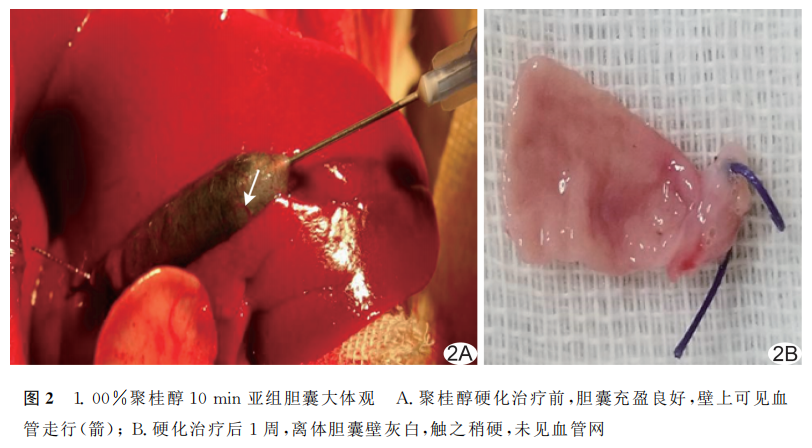
2.2 聚桂醇注入前后胆囊变化
2.2.1 大体观
治疗前胆囊充盈良好,壁上血管走行清晰可见。硬化治疗后1周,自肝脏剥离的胆囊组织质地稍硬,胆囊体积较硬化前缩小,囊壁轮廓尚正常、形态欠饱满,色灰白,弹性差,未见血管网,部分囊内可见少量分泌物。见图2。
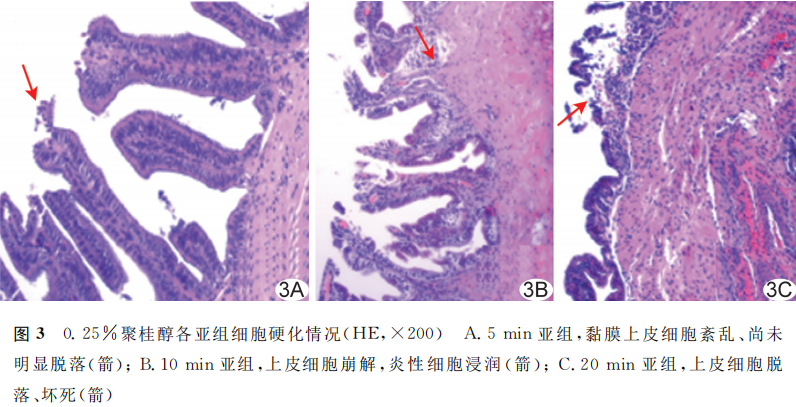
2.2.2 病理表现
2.2.2.1 0.25%聚桂醇
在术后1周,观察组血清CRP、Cor和SAA水平显著低于对照组(P<0.05,表3)。
2.2.2.2 0.5%聚桂醇
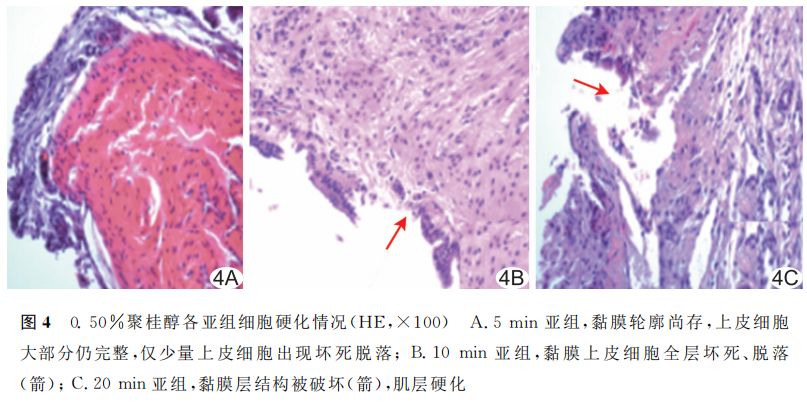
硬化治疗后1周,5min亚组胆囊黏膜轮廓尚存,上皮细胞大部分仍完整,仅少量上皮细胞坏死脱落;10min亚组大部分上皮细胞全层破坏,黏膜部分轮廓尚可见;20min亚组绝大部分黏膜结构破坏,上皮细胞全层坏死、脱落,硬化累及肌层清晰可见。见图4。

2.2.2.3 1.00%聚桂醇
硬化治疗1周后,各亚组均出现不同程度囊壁变性坏死。5min亚组局部黏膜上皮细胞全层崩解,残留少数黏膜上皮细胞残影;10min亚组黏膜上皮结构基本消失,黏膜下肌层见少量出血;20min亚组上皮细胞完全脱落、坏死,未见正常黏膜结构,黏膜下肌层大量红细胞浸润。见图5。
2.3 浓度与时间交互作用
以各组治疗后胆囊最大横径作为评价指标进行析因设计,结果显示聚桂醇浓度与作用时间对硬化治疗效果的影响存在交互作用(P=0.019);分析作用时间的单独效应,不同作用时间胆囊最大横径差异有统计学意义(P=0.001);分析聚桂醇浓度的单独效应,不同药物浓度间胆囊最大横径差异无统计学意义(P=0.317)。见表2。两因素析因设计组合中,0.50%聚桂醇浓度作用10min时K值最大(6.19),即硬化治疗效果最好,见表3。
三、讨论
肝囊肿是一种较常见的肝脏良性病变,多为先天性肝囊肿,其发病率为3.1%,且多见于40岁以上女性[9]。由于肝囊肿生长非常缓慢,肝囊肿患者长期无明显症状,甚至可能终生无明显感觉。当囊肿直径达10 cm时可能出现脏器压迫症状[10]。巨大肝囊肿可能发生破裂,诱发急性肺栓塞,导致囊内感染和出血[11]。因此,当囊肿直径大于5 cm时,即使无临床症状,也需要及时进行治疗。对于巨大肝囊肿,临床通常采取外科手术或穿刺引流治疗,而超声引导下穿刺硬化治疗最为常用。超声引导下的囊肿穿刺抽吸硬化治疗是一种微创手术,在超声定位引导下,经皮穿刺抽取囊肿中的囊液后,向囊内注入硬化剂进行治疗[12]。无水乙醇是治疗单纯性肝囊肿常用的硬化剂,广泛应用于临床各种囊肿的治疗,临床效果确切,但因其具有腹胀、腹痛、醉酒样反应、发热、恶心等多种不良反应,影响了治疗效果[13,14]。聚桂醇作为新型硬化剂,主要用于食管静脉曲张出血的急诊止血和曲张静脉、腹膜后淋巴管瘤等的硬化治疗[15]。多项临床研究报道[16,17],聚桂醇作为硬化剂用于超声引导下的穿刺硬化治疗肝囊肿效果更佳。
本研究结果显示,与无水乙醇硬化剂相比,超声引导下穿刺抽液联合聚桂醇置换冲洗硬化治疗总有效率显著提高。应用无水乙醇硬化,部分患者因疼痛刺激,导致囊液渗出,导致治愈率降低。聚桂醇能破坏囊壁内皮细胞,产生无菌性炎症反应,使内皮组织萎缩、囊腔粘性闭合,同时具有止痛和消炎的作用。本研究结果显示,治疗前后所有纳入对象肝功能均无明显变化。相关研究报道[18,19],在进行超声引导下穿刺等侵入性操作治疗时,可能导致患者出现应激反应。CRP是由肝脏合成的一种急性时相蛋白,在应激状态下明显升高[20];SAA是一种新的敏感炎性反应标志物,同属于急性时相反应蛋白,在应激状态下该指标会显著上升[21];Cor是由肾上腺皮质分泌的“应激激素”,属于糖皮质激素的一种。同样,在应激状态下其水平明显升高[22]。本研究结果显示,穿刺治疗后两组肝囊肿患者血清CRP、Cor、SAA水平均升高,而在术后1周,聚桂醇硬化治疗患者血清CRP、Cor和SAA水平显著低于无水乙醇硬化治疗者,提示聚桂醇作为硬化剂治疗对巨大肝囊肿患者应激反应较轻。
对于硬化剂的选择,以前大多数用无水乙醇,而多项临床研究报道[23,24],无水乙醇的使用可能会发生发热、腹胀、腹痛、出血、恶心、呕吐、醉酒样反应和肝功能异常等不良反应。应用聚桂醇治疗,疗效更优,其优点还在于无刺激性、不引起剧痛、无醉酒样反应。本研究结果发现,术后1周,使用聚桂醇硬化治疗的巨大肝囊肿患者术后不良反应发生率低,进一步验证了聚桂醇治疗的安全性。聚桂醇有局部镇痛作用,且能够损伤血管内皮,起到止血作用。同时,它不会产生类似无水乙醇的醉酒样反应。
综上所述,在超声引导下穿刺抽液联合聚桂醇置换冲洗硬化治疗巨大肝囊肿患者可获得良好的临床疗效,机体应激反应轻。鉴于肝囊肿好发与中老年女性,可能合并存在的全身系统性疾病,如高血压、糖尿病或心血管系统疾病造成凝血功能损害,对治疗的进行产生干扰。这些需认真控制,以获得良好的治疗效果。









