发布时间:2025-01-10 08:37:35 来源: 浏览次数:537
《中华小儿外科杂志》2024 年 12 月第 45 卷第 12 期
聚桂醇硬化治疗儿童巨大脾囊肿1例
徐魏军 杨泽胜 裴广华
天津市儿童医院(天津大学儿童医院)超声科,天津市儿科研究所天津市儿童出生缺陷防治重点实验室,天津 300134
患儿 女,10岁,发现腹部肿物1周,2023年2月18日于天津市儿童医院就诊入院,否认腹部外伤史及疫区旅居史。腹部专科检查提示:腹部不胀,未见胃肠型及蠕动波,全腹压痛、反跳痛阴性,肌紧张阴性,左上腹可触及一肿物,大小约120 mm×100 mm,质地韧,无触痛,活动度差,移动性浊音阴性,肠鸣音可闻及。CT:左中上腹囊性包块,边界清晰,大小约107 mm×83 mm×122 mm。CT增强:左中上腹囊性包块无明显强化,临近脾动静脉推挤上移,左肾向上移位,左肾动静脉明显受压,胰腺及胃受压推挤右移(图1),盆腔积液。超声检查:左上腹可见无回声肿块,内充满细密点状中等回声,动态观察可见内容物流动,肿块壁薄,边界清晰,形态规整,约 118 mm×81 mm×102 mm。彩色多普勒血流成像:肿块内未见血流信号,肿物与脾脏关系密切,受肿物影响,胰尾部显示不清,左肾受压移位。超声结论:左上腹囊性肿块,考虑来源于脾脏。随后患儿行腹腔镜下腹腔探查术、脾囊肿去顶减压术、腹腔引流术,探查见肿物来源于脾脏,脾脏增大,肿物呈囊性,位于脾脏中下部临近脾门,于肿物下极开孔减压,见大量黄绿色液体流出,吸净囊内液体,查无活动性出血,取部分肿物囊壁送病理。术后病理:送检灰白灰褐色片状组织一块,大小 12 mm×5 mm×3 mm,镜下见纤维囊壁样组织,未见明显上皮或内皮衬覆,囊壁内血管淤血,局灶出血,可见散在淋巴细胞,免疫组织化学:CK(?)、CD31 囊壁内脉管(+),考虑脾脏单纯性囊肿(图 2)。术后 9 d复查超声,囊肿大 小 约 90 mm×53 mm×84 mm、术后 1 个月囊肿大小约110 mm×86 mm×84 mm、术后2个月囊肿大小约120 mm×92 mm×100 mm。经多学科讨论,囊肿巨大且临近脾门,脾脏部分切除术出血风险大,需行全脾切除术。考虑到可能出现脾切除术后凶险性感染等严重并发症,且家长拒绝行全脾切除,遂行超声引导下聚桂醇硬化治疗。
术前血常规:C 反应蛋白<0. 50 mg/L,白细胞 5. 41×109/L,中性粒细胞比率为52. 1%,淋巴细胞比率为42. 5%,单核细胞比率为 3. 9%,嗜酸性粒细胞比率为 0. 9%,嗜碱性粒细胞比率为 0. 6%,红细胞 4. 41×1012/L,血红蛋白 116 g/L,血小板224×109/L。患儿俯卧位,常规消毒铺巾,2%利多卡因局部麻醉,超声引导下行脾脏囊肿穿刺硬化治疗,使用ARROW(ES?04706)中心静脉置管包行脾囊肿置管引流,18G×63.5 mm 穿刺针穿刺囊肿,回抽液体后置入导丝(0. 81 mm×450 mm)(图 3),固定导丝拔除穿刺针,沿导丝置入扩张器扩皮,拔除扩张器,沿导丝置入引流管(14G×160 mm),自囊肿引流出深绿色液体约 650 ml(图 4)后,用60 ml生理盐水冲洗囊腔至囊液清亮,再用20ml聚桂醇(规格10 ml∶100 mg)反复冲洗囊腔(图5)约60 min后抽出,最后将10 ml聚桂醇与空气(1∶3)配制成40 ml微泡于囊腔内留置(图 6),拔除引流管,术毕查无活动性出血,患儿无不适安全返回病房。术后当晚患儿体温升高38. 7℃,予以布洛芬退热对症处理,患儿体温可降至37. 2℃,次日查血常规:C反应蛋白16. 6 mg/L,白细胞 14. 64×109/L,中性粒细胞比率78. 6%,淋巴细胞比率14. 8%,单核细胞比率 6. 1%,嗜酸性粒细胞比率 0. 1%,嗜碱性粒细胞比率 0. 4%,红细胞4. 93×1012/L,血红蛋白128 g/L,血小板 278×109/L。行静脉输注厄他培南抗感染治疗,3 d 后患儿病情平稳,体温不高,无腹痛腹胀 、恶心呕吐等不适 。复查血常规 :C 反应蛋白24. 4 mg/L,白细胞 7. 24×109/L,中性粒细胞比率 62. 4%,淋巴细胞比率 30. 2%,单核细胞比率 5. 7%,嗜酸性粒细胞比率1. 0%,嗜碱性粒细胞比率0. 7%,红细胞4. 46×1012/L,血红蛋白 115 g/L,血小板 224×109/L。应患儿家属要求自动出院。硬化治疗后 1个月复查超声,囊肿大小约 74 mm×44 mm×62 mm。硬化治疗后 2 个月复查血常规,C 反应蛋白 2. 3 mg/L,白细胞 5. 66×109/L,中性粒细胞比率 53. 2%,淋巴细胞比率 42. 0%,单核细胞比率 2. 8%,嗜酸性粒细胞比率1. 6%,嗜碱性粒细胞比率0. 4%,红细胞4. 46×1012/L,血红蛋白 117 g/L,血小板 227×109/L;复查超声,囊肿大小约 50 mm×40 mm×46 mm。遂行第 2 次囊肿硬化治疗,患儿仰卧位,常规消毒铺巾,2% 利多卡因局部麻醉,超声引导下行脾囊肿硬化治疗,使用 LEAPMED一次性穿刺针(18G×150 mm)穿刺囊肿,自囊腔内抽出暗红色液体约30 ml后,用20 ml生理盐水冲洗囊腔至囊液清亮,再用20 ml聚桂醇反复冲洗囊腔30 min(图7),最后将10 ml聚桂醇囊腔内留置,拔除穿刺针,术毕查无活动性出血,患儿无不适安全返回病房,术后患儿无体温升高等不适,于次日出院。第 2次硬化治疗后3个月复查超声,囊肿大小约14 mm×7 mm×12 mm。第2次硬化治疗后6个月复查超声,囊肿几乎消失,仅残留大小约7 mm×3 mm×2 mm小囊腔(图8)。
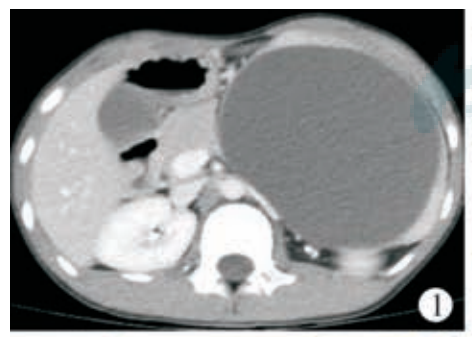
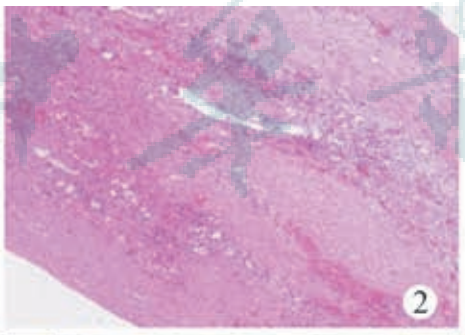
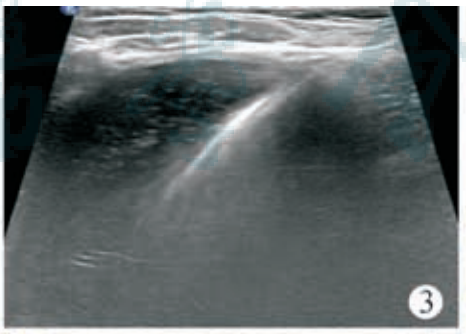

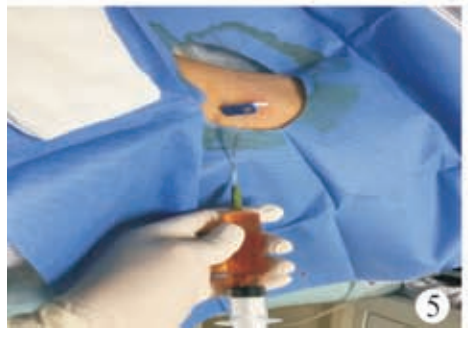
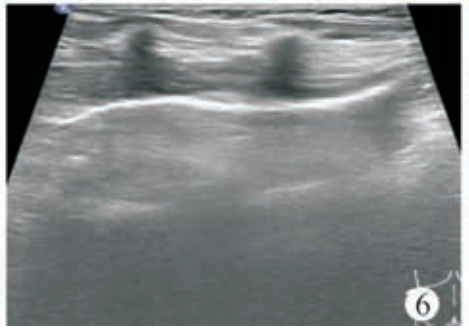
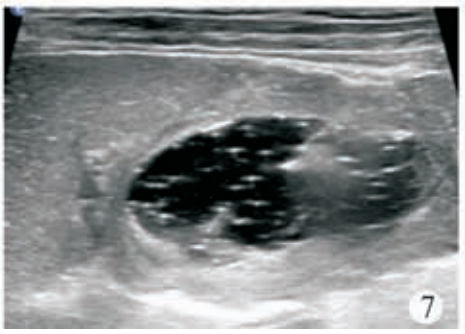
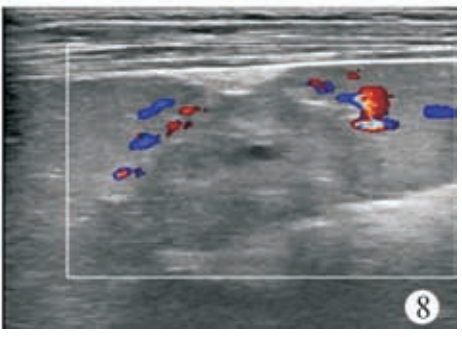
图1 脾囊肿患儿CT增强检查,显示左中上腹囊性包块无明显强化,临近脾动静脉推挤上移,左肾向上移位,左肾动静脉明显受压,胰腺及胃受压推挤右移
图2病理检查(HE染色,×100),镜下见纤维囊壁样组织,未见明显上皮或内皮衬覆,囊壁内血管淤血,局灶出血,可见散在淋巴细胞,考虑脾脏单纯性囊肿
图3超声引导下行聚桂醇硬化治疗,穿刺针穿刺囊肿,回抽液体后置入导丝
图4 脾囊肿患儿首次硬化治疗自囊肿内引流出深绿色液体约650ml
图5聚桂醇冲洗脾囊肿
图6首次硬化治疗超声,将聚桂醇与空气配制成微泡于囊腔内留置
图7第2次硬化治疗超声,经穿刺针用聚桂醇反复冲洗囊腔
图8第2次硬化治疗后6个月复查超声,囊肿几乎消失,残留囊腔大小约7 mm×3 mm×2 mm
讨论 脾囊肿根据病理类型分为寄生虫性和非寄生虫性。寄生虫性多见于非洲和中美洲,通常由细粒棘球蚴病引起,也称脾包虫病;非寄生虫性又可以分为原发性和继发性。原发性脾囊肿囊壁有上皮内衬,是真正的囊肿,包括先天性(表皮样囊肿、皮样囊肿和单纯性囊肿)和肿瘤性(血管瘤、淋巴管瘤、囊性转移瘤);继发性脾囊肿囊壁无上皮内衬为假性囊肿,通常被认为继发于脾创伤、梗死或脓肿[1?3]。但有学者指出,囊壁无上皮内衬不是继发性囊肿的决定性证据[3]。本例囊壁无上皮或内皮衬覆,但患儿无创伤等继发因素,病理最终诊断为内衬细胞脱落所形成的单纯性囊肿。
脾囊肿的治疗目前尚无统一的方法,成年患者囊肿直径<50 mm且无临床症状时一般采用保守治疗,直径≥50 mm或有临床症状一般需要临床干预。有学者指出儿童患者活泼好动且脾是最易受钝性损伤的实质脏器,因此建议对有临床症状或囊肿直径≥40 mm 的儿童脾囊肿进行临床干预[2]。临床干预方式主要有全脾切除和保留脾脏两种,20 世纪80年代之前,全脾切除术是治疗该病的经典术式,但术后有0. 2%~0. 5%发生暴发性感染的可能且死亡率高达60%,因此保脾成为目前临床干预脾囊肿的主流。保脾方式主要有囊肿剥除术、囊肿开窗引流术、囊肿去顶毁底术、部分脾切除术、囊肿介入硬化治疗。囊肿剥除术因手术时间长且术中容易出血等,外科不推荐。囊肿开窗引流术因其复发率高而不推荐[2]。有学者认为腹腔镜下囊肿开窗引流术治疗儿童脾囊肿操作简单安全可行[4]。本例患儿手术即采用此法,但术后短期内复发。姜洪池和李丹[5]将“开窗引流术”改进为“去顶毁底术”,即先切除囊肿顶部(范围≥1/2囊壁),然后再用氩气刀、滴水双极或电刀等器械破坏囊肿基底部,此法具有术式简单、创伤小、操作时间短、复发率低等优点,但未来的广泛适用性特别是较大直径囊肿的可行性尚需临床进一步验证。部分脾切除术已被多数学者认可并采用,但此法手术切缘易出血,对术者的经验要求较高[6]。囊肿介入硬化治疗是一种创新的侵入性小的治疗方法,与手术相比更微创,并发症更少,住院时间更短,费用更低。本例患儿术前术后血常规对比无显著变化,说明硬化治疗未对脾脏功能产生明显影响。最近研究发现硬化治疗脾囊肿安全有效,特别是囊肿直径<80 mm时,复发率可降至7%,优于腹腔镜保脾手术。但囊肿直径≥80 mm时,也有学者认为囊肿直径≥200 mm时,囊肿有较高的复发率[6?8]。
本例囊肿最大径达到120 mm,硬化效果显著,能够成功硬化需要注意以下几点,①穿刺方式,较小囊肿可选择一次性穿刺针穿刺硬化,针尖穿刺至囊腔深部 1/3处便于吸净囊液,抽吸囊液时囊内可留极少量液体用于观察针尖,以免针尖脱出囊腔或穿出囊腔损伤周围脏器,此方式操作简单,对囊壁损伤小,适合小囊肿短时硬化治疗;较大囊肿更适合选择置管方式硬化,因为一次性穿刺针的长度及形态固定不适合较大囊肿抽吸前后囊壁位移大的特点,而且较大囊肿后续操作时间长,一次性穿刺针很难稳定固定。置管方式有一步法和两步法,一步法是在超声引导下一次性完成穿刺并置入导管,其操作时间短,减少了对囊壁的多次穿刺和操作,缺点是操作难度较大,出现误差可能会增加囊肿破裂或出血的风险;两步法是在超声引导下分两步完成穿刺置管,首先置入导丝,然后沿导丝置入导管,其优点是有足够的时间来确认导丝是否进入合适的位置,降低了一步法可能出现的误差,操作难度较低,适合在复杂情况下使用,缺点是操作时间较长,可能会增加感染风险。注入硬化剂前均应确保针尖或导管在囊腔内,否则禁止注入硬化剂,不能确定时可在超声监视下试验性注入少量生理盐水或造影剂,若囊腔逐渐充盈且注入液可顺利回抽则可注射硬化剂。本例患儿首次硬化治疗时,囊肿体积较大,情况较复杂,故采用两步法置管硬化。成功置管是完成硬化的关键,术前需选取囊壁薄、脾实质少的地方作为穿刺点以减少脾脏出血的可能性。囊肿体积巨大,引流前后囊肿相对位移明显,应提前预判囊肿回缩方向,穿刺点应选取相对位移小的点,且引流管要足够长,以免引流过程中囊壁因过度牵拉造成破裂或引流管脱出造成囊液或硬化剂外漏。本例患儿首次硬化治疗选取背部穿刺,兼顾位移小、囊壁薄。第 2 次硬化治疗时囊肿明显缩小,周围囊壁较厚,置管容易造成出血,故改用一次性穿刺针穿刺硬化。②囊液引流彻底后,先用生理盐水反复冲洗至囊液清亮,使囊壁表面无残留物覆盖,为硬化剂与囊壁充分作用做好准备。③冲洗技巧,术中用硬化剂原液反复快速推注冲洗囊腔60 min,可使硬化剂在囊腔内多角度涡流旋转,与各方位囊壁充分有效接触以达到良好的硬化效果。有学者采用注入硬化剂后改变体位使囊壁更全面接触硬化剂,但此操作有牵拉引流管造成患儿疼痛不配合和硬化剂外漏的风险[8]。④硬化剂用量目前没有统一标准,部分学者根据囊肿大小确定聚桂醇参考剂量,直径<50 mm或囊液<100 ml使用 10 ml,直径5~7 cm或囊液<300 ml使用20 ml,直径≥80 mm或囊液>300 ml 使用 30~40 ml[9]。《多脏器囊肿硬化治疗中国专家共识(2021 版)》[10]指出,最大直径≥10 cm 的囊肿,可选择聚桂醇原液冲洗抽尽后,使用液气比为 1:2~1:4的聚桂醇泡沫硬化剂40~80 ml进行留置,但此标准为成人用量,故本例患儿采用相对安全的最低剂量,聚桂醇单次总用量为 30 ml。首次由于囊腔较大,将10 ml硬化剂与空 气(1:3)制备成40 ml泡沫留置,第2次硬化治疗时囊腔明显变小,故将10 ml硬化剂原液留置,使残留囊壁后续持续得到硬化。应避免留置硬化剂过多造成硬化剂外漏。⑤硬化治疗后的超声评价时间节点和后续选择二次硬化治疗指征目前没有统一标准,主要取决于操作者的经验[8,11]。超声评价时间节点一般为术后 1、3、6、12 个月或 3、6 个月[9,12]。部分学者选择短期随访(2~4 周),若囊肿复发或残留囊肿>50 mm,则选择二次治疗[8]。结合文献报道较大脾囊肿(≥80 mm)常需要多次硬化治疗且复发率高的特点[6?8],本例患儿在首次硬化治疗2个月后残留囊腔仍达到50 mm,为了巩固前期治疗效果选择了积极二次硬化治疗。
脾囊肿较腹腔其他实质脏器囊肿少见,硬化治疗没有统一的标准,本例治疗过程尚存在一些不足,如 2 次硬化治疗后超声随访时间节点不同,同质化规律随访或更有利于效果评价;首次硬化治疗后囊肿连续 2 个月进行性缩小,若选择进一步观察待囊肿体积稳定或囊肿复发后再进行二次干预,患儿是否会获益更多等。
总之,儿童脾囊肿相对罕见,硬化治疗是一种安全有效的治疗方式,为脾囊肿患儿保留脾脏提供了一种可行的选择,特别是不愿接受手术治疗的家庭。