论著·超声内镜引导下曲张静脉精准断流术治疗食管胃底静脉曲张有效性及安全性的初步研究
王治虹 时晨 曾壮 陈丽红 张倩倩 张辅民 梅雪灿 王曦 孔德润
安徽医科大学第一附属医院消化内科 安徽省消化病重点实验室
通信作者:
孔德润,Email:kongderun@ahmu.edu.cn
肝硬化患者胃底静脉曲张的发生率约为20%,虽低于肝硬化患者食管静脉曲张的发生率,但出血量更大、发生破裂出血更频繁。研究发现,肝硬化失代偿期合并食管胃底静脉曲张的患者,其胃底曲张静脉以年均8%的增长速度进展为更为粗大的血管。最早,Sarin采用内镜下硬化剂注射治疗胃底静脉曲张,在反复注射治疗后只有71.6%的曲张静脉实现血管闭塞,且孤立性胃底曲张静脉注射治疗后再出血率高达53%。组织胶(氰基丙烯酸)治疗静脉曲张的首次报道见于1986年,随后组织胶治疗胃底静脉曲张取得了巨大成功,但注射后排胶溃疡导致的出血并不少见,这也是内镜下组织胶注射治疗胃底静脉曲张需要关注的主要问题之一。近年来随着超声内镜技术的发展,超声内镜引导下曲张静脉精准断流术(EUS?SVD)被逐步应用于食管胃底静脉曲张的治疗。由于EUS?SVD术中能够利用超声内镜实时精准定位黏膜下血管,做到有效止血,且具有减少组织胶用量、实时评价治疗效果等优点,因此在Baveno Ⅶ共识中被推荐用于胃底静脉曲张的治疗。但这一新技术在国内报道尚少,为获取更多临床经验,笔者对我院近年开展该技术治疗的食管胃底静脉曲张病例进行了回顾性总结和分析,现将初步研究结果报道如下。
资料与方法
一、病例收集及分组
本研究为回顾性研究,已取得我院伦理委员会批准(伦理编号:PJ?2022?02?33),以2021年2月—12月在我科行传统胃镜下硬化剂组织胶注射或EUS?SVD治疗的肝硬化食管胃底静脉曲张病例为研究对象,依据内镜治疗方法分为EUS?SVD治疗组(超声内镜组)和传统胃镜下硬化剂组织胶注射治疗组(传统胃镜组)。(1)纳入标准:①年龄18~80岁,性别不限;②LDRf分型标准Le,g型食管胃底静脉曲张,即食管曲张静脉与胃底曲张静脉完全相通型;③行传统胃镜下硬化剂组织胶注射或EUS?SVD治疗。(2)排除标准:①合并有其他脏器恶性肿瘤或肝肾综合征、肝性脑病等严重并发症者;②术前CT血管成像示存在巨大脾-肾分流者;③资料不完整者。最终共入组43例病例数据进行统计学分析,超声内镜组22例、传统胃镜组21例。
二、内镜治疗
1.使用器械:纵扫线阵超声内镜(日本Fujifilm EG?580UT),内镜穿刺针(日本Olympus NM?400L?0423注射针,美国Boston Scientific M00518310 23 G一次性体内注射治疗针),传统白光胃镜(日本Olympus GIF Q260J),内镜测量尺(日本Olympus M2?2C 10 mm、M2?2U 20 mm),1%聚桂醇注射液(陕西天宇,10 mL/支),2?氰基丙烯酸正丁酯(德国贝朗,0.5 mL/支)。
2.内镜操作:所有患者评估心率、血压等生命体征合格后,于气管插管复合静脉麻醉下进行超声内镜引导下或传统胃镜下硬化剂组织胶注射治疗。
(1)EUS?SVD:先用白光胃镜检查食管胃底静脉曲张类型(图1),达到入组标准Le,g型,再换用线阵超声内镜扫查,在贲门近食管可见壁外穿通支及贲门处胃壁内条索状无回声区,需扫及血流信号确定为血管,测量血管直径(图2),血流频谱检测确定为静脉血流。选取直径4~5 mm以上有壁外来源的血管,确定为注射的靶血管。超声内镜实时引导下取适宜注射点,采取“三明治”法(聚桂醇-组织胶-生理盐水)对靶血管行硬化剂组织胶注射。先注射聚桂醇0.5 mL,如果确定血管内,继续注射5~10 mL聚桂醇;再注射组织胶,用量依据血管直径,直径0.5~1.0 cm血管注射0.5 mL组织胶,1.0 cm以上血管注射1.0 mL组织胶,注射后超声内镜下可见局部血流即刻消失,血管腔内见高回声组织胶充填;最后用白光胃镜观察,注射血管是否固化、注射点有无出血(图3)、与注射胃底曲张静脉连续的食管曲张静脉内是否有白色胶体填充。

图1 白光胃镜检查食管胃底静脉曲张类型 图2 超声内镜扫及血流信号确定为血管,测量血管直径 图3 白光镜观察注射血管是否固化、注射点有无出血
(2)传统胃镜下硬化剂组织胶注射:由胃镜活检孔插入测量尺,根据胃底曲张静脉位置调节测量尺,放置在最大直径的血管处,测量血管直径。再用透明注射针在胃底依次探查隆起的曲张静脉,只有见到针内柱状回血后方可注射聚桂醇及组织胶,用量同前,直至血管固化。
3.术后处理及随访:术后禁食24 h、抑酸、抗感染、监测生命体征。术后1~2个月随访胃镜,其间若有再出血的患者立即行胃镜检查,判断食管胃底曲张静脉情况,并与术前胃镜结果对比,必要时追加治疗。
三、观察指标及相关定义
1.主要观察指标:包括术后2个月内食管静脉曲张治疗有效率、术后3个月内再出血率以及不良反应。
根据指南制定食管静脉曲张疗效评估标准:(1)有效,指静脉曲张由重度变为中度、轻度或消失,或由中度变为轻度或消失;(2)无效,指静脉曲张分级无明显减低[3]。食管静脉曲张治疗有效率=治疗有效例数/治疗总例数×100%。根据相关推荐,通过曲张静脉形态、是否有红色征及出血危险程度将食管静脉曲张分级定义为轻、中、重度。静脉曲张消失定义为内镜治疗结束后,消化道溃疡糜烂完全消失后,内镜下看不到曲张静脉或仅可见残留的细小血管。
术后3个月内再出血定义为术后3个月内,再次发生食管胃底曲张静脉破裂出血(呕血、黑便或便血)。
不良反应分为轻度和重度。轻度不良反应包括疼痛、发热、恶心呕吐、胃底排胶溃疡及术后72 h内再出血;重度不良反应指远处器官异位栓塞、患者死亡。其中,胃底排胶溃疡指内镜复查时注射处可见明显溃疡形成,直径超过5 mm;术后72 h内再出血指术后72 h内患者出现消化道出血。
2.次要观察指标:包括硬化剂用量、组织胶用量。
四、统计学分析
采用SPSS 25.0统计学软件处理数据。正态分布及近似正态分布的计量资料用图片图片表示,2组间的比较行t检验;计数资料用频数(%)表示,2组间的比较行卡方检验或Fisher确切概率法。P<0.05为差异有统计学意义。
结 果
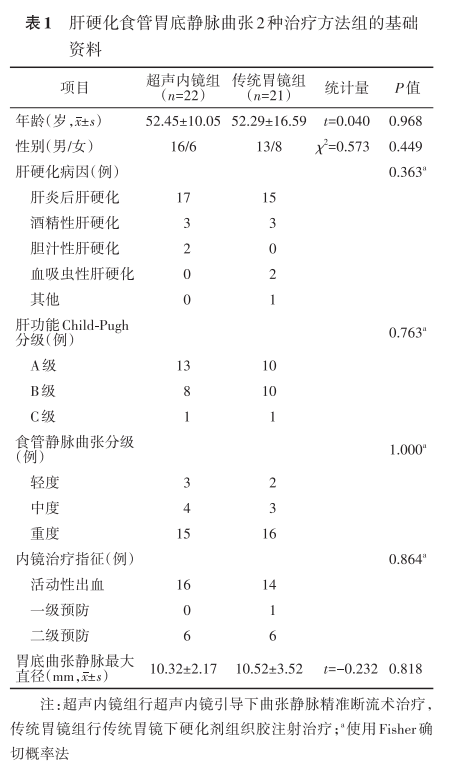
一、基线资料比较
患者平均年龄、性别构成、肝硬化病因构成、肝功能Child?Pugh分级构成、食管静脉曲张分级构成、内镜治疗指征构成以及胃底曲张静脉平均最大直径方面,2组间比较差异均无统计学意义(表1)。术前门静脉CTA检查提示共有27例存在胃-肾分流,超声内镜组(n=15)分流道直径(6.92±3.33)mm,传统胃镜组(n=12)分流道直径(5.39±2.82)mm,两者间分流道平均直径比较差异无统计学意义(t=1.364,P=0.183)。
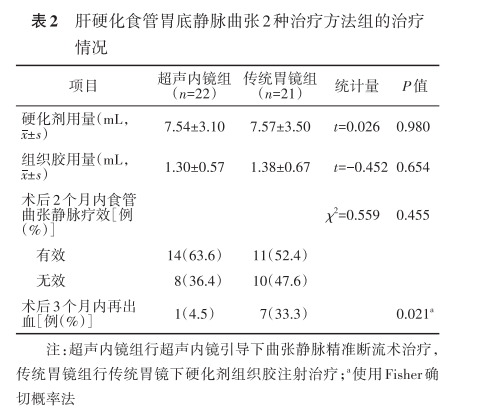
二、治疗情况
超声内镜组术中可检测胃底曲张静脉的胃壁外穿通支静脉,最大穿通支静脉直径为(7.85±2.96)mm,而传统胃镜组无法检测;超声内镜组硬化剂组织胶注射治疗后,胃底曲张静脉均消失,达到靶血管闭塞,而传统胃镜组无法检测。硬化剂平均用量、组织胶平均用量超声内镜组与传统胃镜组比较,差异均无统计学意义;术后2个月内食管静脉曲张治疗有效率超声内镜组高于传统胃镜组,但差异无统计学意义;术后3个月内再出血率超声内镜组低于传统胃镜组,差异有统计学意义(表2)。
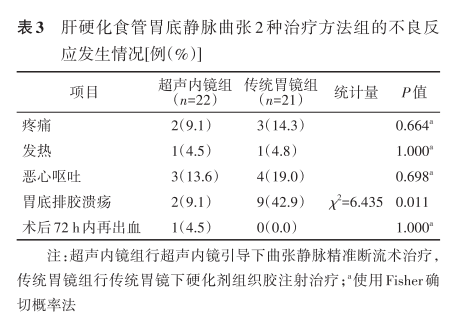
三、不良反应发生情况
2组均未发生异位栓塞和死亡事件。术后疼痛、发热及恶心呕吐发生率方面,2组间比较差异均无统计学意义;胃底排胶溃疡发生率超声内镜组低于传统胃镜组,差异有统计学意义;术后72 h内再出血率超声内镜组高于传统胃镜组,但差异无统计学意义(表3)。
讨 论
近年来,国内外共识指南均指出,食管胃底静脉曲张(LDRf分型标准Le,g型,或者Sarin分型GOV1型)应先处理胃底曲张静脉,再处理食管曲张静脉,且组织胶注射是胃底曲张静脉治疗的首选方法,可降低胃底静脉曲张的再出血率。但是传统内镜下操作,由于胃底曲张静脉与黏膜皱襞难以区别,且胃底曲张静脉在黏膜下较深位置,组织胶有可能注射至黏膜下层或肌层,导致难以愈合的溃疡或出血等更严重并发症。为了降低穿刺的不确定性,提高安全性及疗效,EUS?SVD方法显示了独特的优势,因此得到Baveno Ⅵ共识的推荐。EUS?SVD能够实时观测胃壁内外穿通支血管形态,更客观、精准定位和评估胃底曲张静脉,但国内目前EUS?SVD文献仍较少。
本组资料中,超声内镜组治疗后胃底曲张静脉均消失,血管闭塞率达100%,术后3个月内再出血率(4.5%)、胃底排胶溃疡发生率(9.1%)均明显低于传统胃镜组(分别为33.3%、42.9%)。研究显示,血管大小和胃壁内外穿通支静脉的存在是胃底静脉曲张治疗后再出血的危险因素,来源穿通支的闭塞决定了曲张静脉能否根除,是后期复发和再出血的关键因素。传统胃镜下是针对隆起可疑的血管,依据穿刺是否回血来进一步判断与治疗,但传统胃镜不能确定血管腔内直径,无法判断是否适合穿刺,难以选择胃壁内外交通支血管,因此难以达到最好效果,并且穿刺部位可能是细小血管,组织胶易外溢至黏膜下层,形成后期的巨大溃疡,导致出血风险增高。基于以上原因,本组资料中,传统胃镜组尽管观察到注射针回血,但胃底排胶溃疡发生率仍高达42.9%。超声内镜在实时与可视化方面具有明显优势,可以明确最适宜的注射点,因此超声内镜引导下注射治疗后发生再出血及溃疡较少。本研究中,利用超声内镜能够明确胃底曲张静脉腔直径,测得胃壁内外穿通支血管,其最大直径为(7.85±2.96)mm,适合血管穿刺,治疗后血管闭塞率达100%。
EUS?SVD穿刺点选择邻近胃壁内外血管穿通支,治疗后改白光镜观察,穿刺点多在远离贲门下方的胃小弯侧,血管位于黏膜下层深处,并不是隆起最明显部位,白光内镜下难以发现,因此EUS?SVD的胃底曲张静脉检出率要高于白光内镜。既往文献报道,超声内镜下胃底静脉曲张发现率可以提高6倍,这也是EUS?SVD的优势之一。此外,既往文献已证明残余血流与再出血风险密切相关。EUS?SVD可以监测曲张静脉的血流状况,评估穿通支静脉大小及体积,精准把控组织胶用量,确认术后血管闭塞与血流消失,这对于预后有非常重要的临床价值。
胃底静脉曲张组织胶注射治疗需要特别注意的是异位栓塞风险。有研究表明,16.86%的肝硬化合并门静脉高压患者存在自发性分流,Lgf型(IGV1型)均存在分流,其中胃-肾分流占85%,组织胶有可能通过分流道发生远处栓塞。本研究中,食管胃底静脉曲张均为Le,g型(GOV1型),血流方向自贲门下方向上流入食管曲张静脉。由于Le,g型较少合并粗大胃-肾分流道,因而异位栓塞风险较低,本组资料中暂未发现存在远端栓塞的病例,但仍需在术前常规行CTA检查,以了解胃-肾分流状况。
Le,g型静脉曲张的治疗,包含了胃底血管与食管血管的处理。本研究中,首次治疗主要是处理胃底曲张静脉,在胃底曲张静脉栓塞后1~2个月复查解曲张静脉状况,然后再行食管曲张静脉套扎或硬化剂注射治疗。我们观察到,EUS?SVD术后大多数食管静脉曲张分级下降(术后2个月内食管静脉曲张治疗有效率为63.6%),但并不能完全闭塞消失,因为食管曲张静脉除来源于贲门下方血管,还有食管外或者膈下血管,这在我们超声内镜检查来源血管时均有发现。另外,超声内镜也有不足之处,因为胃镜前端弯曲远不如传统胃镜,在贲门下方大弯侧及穹窿部的曲张静脉难以观察与治疗,导致在此部位的部分血管不能行EUS?SVD治疗,这也是曲张静脉根除不彻底的原因之一。本研究中,传统胃镜组在注射治疗后食管曲张静脉也有明显萎缩(术后2个月内食管静脉曲张治疗有效率为52.4%),疗效比EUS?SVD略低,差异无统计学意义。如果综合了胃底排胶溃疡及术后3个月内再出血的发生率,EUS?SVD能给予患者更多获益。胃底血管的栓塞,除了直接影响食管曲张静脉之外,也让后续的食管血管续贯治疗更为有效,因为贲门下方来源血管是食管曲张静脉复发与新生血管的根源。
以往超声内镜引导下胃底曲张静脉的治疗多集中在弹簧圈与组织胶联合治疗,有关EUS?SVD的报道较少。Bick等的研究结果表明,与传统胃镜治疗相比,EUS?SVD的再出血率与不良事件发生率更低,这与我们的结果相一致。国内报道超声内镜用于肝硬化的内镜下诊断和治疗,大多使用的是环扫超声镜,只能观察曲张静脉而不能提供穿刺,环扫超声检查后,必须再改用传统内镜注射组织胶,不能为穿刺提供实时图像与引导,因此不能称之为EUS?SVD。2007年Romero?Castro等首次报道了EUS?SVD治疗胃底静脉曲张的小样本研究,近年来超声技术的发展迅速,EUS?SVD也得到更多专家的认可,特别在可视化、精准注射方面有明显优势。由于EUS?SVD对操作技术要求高,且需插管麻醉而耗费时间,国内报道较少。经文献检索,国内陈明锴等最早开展了EUS弹簧圈置入联合组织胶注射治疗自发性脾-肾分流合并胃底巨大静脉曲张破裂出血并取得了良好效果。另外,陈洪潭、吕瑛等超声内镜专家,在国内各种学术会议上也进行了精彩的操作演示。受制于超声内镜设备与技术,目前国内消化内镜医师从事EUS?SVD的还很少。
综上所述,EUS?SVD能够实时观察胃底曲张静脉及壁内外穿通支血管,实现精准穿刺血管与精准药物用量,术后的排胶溃疡及再出血明显减少,提高了疗效与安全性。后期我们将纳入更多病例并继续随访,以期获得更多经验。另外,EUS?SVD能否获得认可,仍需更多的临床试验,特别是随机对照研究的支持。



