发布时间:2020-12-18 10:13:06 来源: 浏览次数:946
尹明,王中阳,肖蔚(225300 江苏泰州市人民医院超声科、病理科)
摘要:
目的:对比研究聚桂醇、无水乙醇及生理盐水经超声介入硬化治疗荷瘤肝癌模型的作用效果,探讨聚桂醇能否成为治疗原发性肝癌的新型硬化剂。
方法:取BALB/C裸鼠30只及人肝癌HepG2型细胞系构建裸鼠肝癌模型,将18只造模成功荷瘤裸鼠随机分为聚桂醇组(n=6)、无水乙醇组(n=6)及生理盐水组(n=6),分别向模型瘤体中央部位注入相应药物和生理盐水进行治疗实验,观察原发性肝癌状况;超声测量各组瘤体大小,计算肿瘤生长抑制率,苏木精-伊红染色观察瘤体超声影像学改变,镜下观察肿瘤内部及周围病理学改变。
结果:实验鼠造模成功18只,皮下瘤体结节均肉眼可见。聚桂醇组和无水乙醇组肿瘤生长明显受抑制(瘤体缩小,1例完全消失),总有效率100%,肿瘤生长抑制率达77.13%,病理学检查见肿瘤组织大片坏死,细胞核固缩;生理盐水组瘤体体积随时间增加无缓解。
结论:聚桂醇可抑制BALB/C裸鼠原发性肝癌模型,达到与无水乙醇相似的近期硬化效果,有望成为治疗肝癌的理想硬化剂。
关键词:
超声介入;聚桂醇;荷瘤鼠;肝癌
文献编号:
DOI: 10.3969 /j.issn.1008-794X.2016.06.016
原发性肝癌手术切除率低,术后复发率高。随着医学影像技术不断发展,超声引导下介入治疗如物理消融(微波、射频、激光等)、化学消融(各类硬化剂)等具有创伤小、操作简便、费用低等优点而受到广泛接受[1]。超声引导瘤体内注射无水乙醇硬化治疗原发性小肝癌已在临床上广泛应用且疗效肯定[1-3],但无水乙醇术中和术后不良反应大,患者常不能耐受造成疗效不满意;乙醇对肝脏有毒性作用,注射剂量也受限[4]。新型硬化剂聚桂醇安全可靠、术中和术后不良反应小,用于硬化治疗食管胃底静脉曲张、下肢静脉曲张、血管瘤、内痔、单纯性肝肾囊肿、盆腔包裹性积液等效果显著[5-6],但用于硬化治疗小肝癌目前还处于研究阶段。聚桂醇对肝癌细胞株硬化效果的研究已有报道[7],但还未见活体肿瘤内相关研究报道。本研究旨在探讨经皮荷瘤肝癌鼠瘤内注射聚桂醇的硬化效果,为聚桂醇替代无水乙醇用于临床治疗原发性肝癌提供可行性依据。
1. 材料与方法
1.1 实验器材
本实验研究器材包括BALB/C裸鼠30只(6周龄,雄性,体质量18~22g)、人肝癌HepG2型细胞系(均由扬州大学农学院比较医学中心实验动物中心提供)、聚桂醇注射液(规格10ml/100mg,相对分子质量582.8,陕西天宇制药公司)、涡旋振荡器、高速冷冻离心机、M5型全数字彩色多普勒超声诊断仪(深圳迈瑞生物医疗电子公司)。
1.2 实验方法
将人肝癌HepG2型细胞激活并繁殖,振荡、离心、稀释成接种细胞悬液。取BALB/C裸鼠30只,于每只右侧腋窝皮下接种细胞悬液0.2ml。1周后,肉眼可见皮下瘤体结节有18个,肿瘤接种成功率60.0%。将18只荷瘤鼠随机分为生理盐水组、无水乙醇组、聚桂醇组,各6只。使用高频超声探头测量原始瘤体大小,超声引导下将注射针尖刺入瘤体中央部位,分别向生理盐水组、无水乙醇组荷瘤鼠瘤体内注射生理盐水、无水乙醇0.1ml作为对照;向聚桂醇组荷瘤鼠瘤体内注射聚桂醇0.1ml;5d后高频超声测量瘤体大小,并分别追加生理盐水、无水乙醇、聚桂醇各0.1ml;10d后超声测量瘤体大小后颈椎脱臼法处死实验鼠,中央部位切开肿瘤,计算肿瘤体积增大率和缩小率。切取肿瘤组织,4%甲醛固定、常规石腊包埋切片、苏木精-伊红(HE)染色后,在显微镜下观察肿瘤内部及周围病理改变。
1.3 统计学分析
采用SPSS16.0统计软件作单因素方差分析,计量资料以均数±标准差(x±s)表示,P<0.05表示差异有统计学意义,P<0.01表示差异有非常显著性意义。
2. 结果
30只BALB/C裸鼠皮下接种人肝癌HepG2型细胞1周,肉眼可见皮下瘤体结节18只,肿瘤接种成功率为60.0%。超声扫查可见皮下瘤体为椭圆形低回声结节,范围在3.5mm×1.2mm×3.0mm~7.1mm×2.3mm×6.5mm。瘤体分别注射聚桂醇、无水乙醇及生理盐水5d、10d后高频超声测量显示,聚桂醇组(图1)和无水乙醇组肿瘤生长明显受抑制,瘤体缩小,1例完全消失,总有效率达100%,肿瘤生长抑制率达77.13%;生理盐水组瘤体体积随时间增加不断增大(表1、图2)。
图1 高频超声测量聚桂醇治疗组瘤体图像
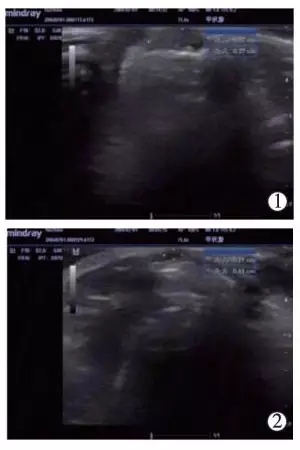
①治疗前肿瘤瘤体;
②注射聚桂醇10d后肿瘤生长受抑,瘤体明显缩小
表1 聚桂醇组与两对照组瘤体体积数据分析x±s
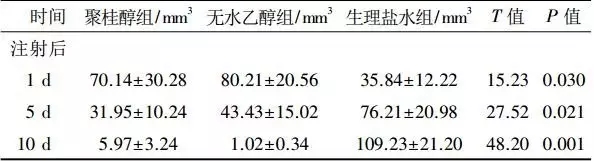
图2 聚桂醇组与两对照组瘤体体积变化趋势图
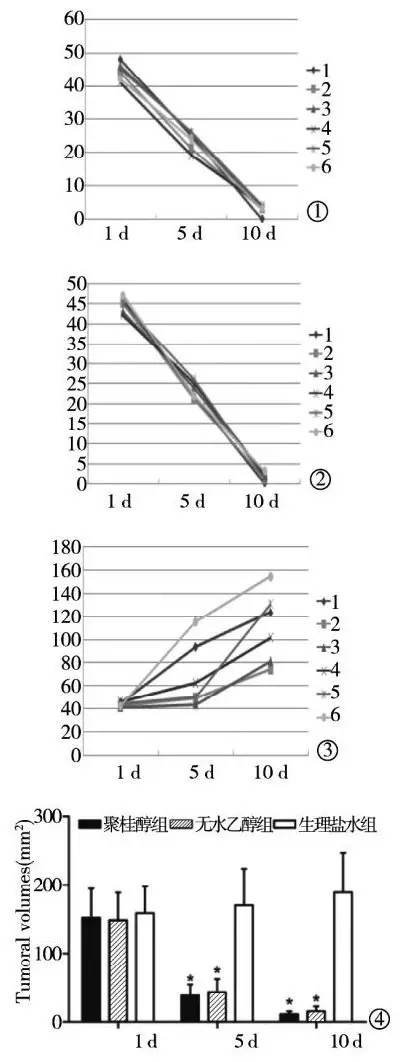
①聚桂醇组瘤体缩小趋势;
②无水乙醇组瘤体缩小趋势;
③生理盐水组瘤体增长趋势;
④3组瘤体变化趋势
HE染色后高倍显微镜下病理学检查结果显示,聚桂醇组肝癌瘤体中央呈大片凝固性坏死,细胞核明显固缩,细胞巢周围纤维增生、包绕,部分病灶周围见急、慢性炎性细胞浸润(图3①),瘤体内细胞完全坏死、坏死区占瘤体面积1/2~2/3、坏死区占瘤体面积1/3~1/2实验鼠各有2只;瘤体周围组织间质水肿,血管扩张、充血,毛细血管增生,纤维组织增生,炎性细胞浸润(图3②)。无水乙醇组病理学检查结果与聚桂醇组类似,瘤体中央呈凝固性坏死(图3③),细胞巢周围纤维增生、包绕,瘤体内细胞完全坏死、坏死区占瘤体面积1/2~2/3、坏死区占瘤体面积1/3~1/2实验鼠分别为3只、2只、1只;瘤体周围组织间质水肿,纤维组织增生,可见淋巴细胞浸润(图3④)。生理盐水组瘤体细胞呈多边形,胞质嗜酸,核大,染色深,核分裂易见(图3⑤),瘤体周围组织水肿,间质内细胞增生,瘤体中央可见少许自发性坏死(图3⑥)。
图3 聚桂醇组与两对照组病理学检查图像
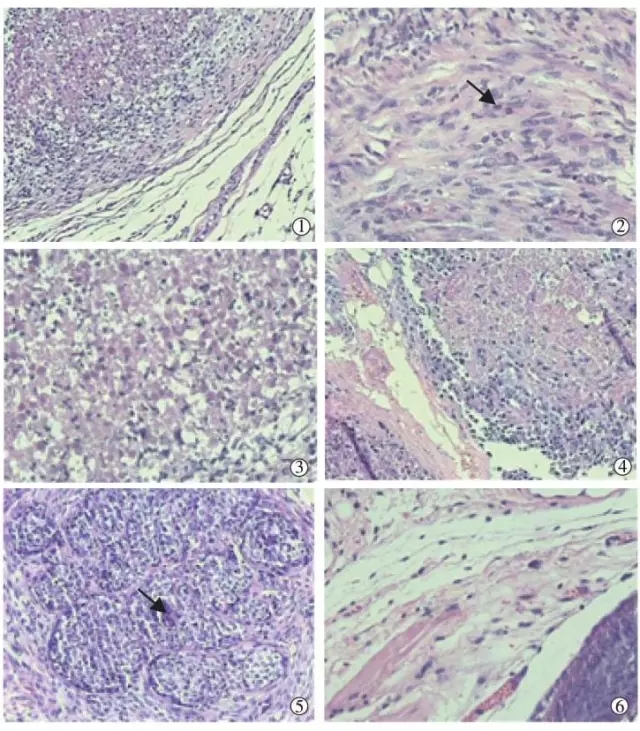
①聚桂醇组瘤体中央呈凝固性坏死;
②瘤体周围纤维组织增生,箭头所指为成纤维细胞;
③无水乙醇组瘤体中央呈凝固性坏死;
④瘤体周围淋巴细胞浸润;
⑤生理盐水组瘤体细胞,箭头所指为多边形癌细胞;
⑥瘤体周围组织水肿
3. 讨论
超声引导下无水乙醇注入瘤内治疗肝癌于1983年临床试验成功并得以较广泛应用,目前仍是促使癌细胞变性坏死最有效的方法之一。无水乙醇有脱水、凝固作用,直接导致瘤体组织缺血、变性坏死;可完全渗透至早期肝癌(直径<3cm)瘤体内,易于达到最大程度灭活癌细胞[8],有效率高达91.67%。但术中推注无水乙醇时瘤体形成一定压力,药液会沿针道流入腹腔,刺激腹膜或肝包膜引起疼痛,同时无水乙醇对正常肝组织有一定损伤,肝功能异常等不良反应随注射次数增加愈发突出,成为临床上不得不注意的问题[9-10]。术后一些患者会出现醉酒样感觉,乙醇过敏的肝癌患者则应慎用该方法。
新型硬化剂聚桂醇是一种具有表面活性的两性分子硬化剂,有固定的亲水和亲油基团在溶液表面定向排列,使液体表面张力显著下降;通过改变界面能量分布,可在数秒钟内使细胞蛋白质析出破坏细胞膜脂质双分子层,导致细胞膜破裂,产生无菌性炎症、纤维组织增生粘连;可使血管内皮细胞、囊肿上皮细胞、内膜及腺体上皮细胞蛋白变性,失去分泌功能,产生粘连和纤维化,聚集成分子团(胶束)与细胞膜脂相互作用,损伤细胞[11-12],从而达到治疗目的[13-14]。由于其为聚氧乙烯月桂醇醚类化合物,具有轻微麻醉效果,术后不良反应小,用于硬化治疗肝囊肿患者均未出现肝功能异常情况[5]。许多研究报道聚桂醇在各种硬化治疗中得到应用[15],其硬化治疗优势在于:①过敏反应发生率低;②不良反应少,几乎无任何刺激性不良作用;③有局部麻醉作用,一旦误入腹腔也不会产生剧烈腹痛。
已有体外研究显示聚桂醇对肝癌细胞株有抑制作用[7],对肝癌治疗可能有效。本实验研究显示实时超声引导下将针尖置于瘤体中央注入聚桂醇,能确保瘤体内药物弥散,通过对细胞膜脱水及对蛋白质变性作用破坏肿瘤组织;治疗组瘤体体积明显缩小,有效率达100%,治疗效果与同等剂量无水乙醇组相似;病理学检查显示治疗组肿瘤细胞呈片状凝固样坏死,瘤体周围组织呈现纤维组织增生,伴炎性细胞浸润(可见淋巴细胞、浆细胞),与无水乙醇组病理学结果相似,而生理盐水组瘤体体积随时间延长不断增大。因此可以认为,聚桂醇治疗具有与无水乙醇相似的杀伤肝癌细胞、抑制肝癌生长效果。
本实验研究将同等剂量聚桂醇直接注入至大小不等瘤体内,使瘤体局部药物浓度很高,病理学检查显示对肿瘤细胞产生直接效果,而浓度较低或未注射到的肿瘤细胞则明显损伤(图4①),因此对较大瘤体应注入更多药物;治疗后10d无水乙醇组瘤体小于聚桂醇组(表1),是同等剂量无水乙醇弥散度较好于聚桂醇的缘故,可视作无水乙醇疗效要略高于聚桂醇,然而无水乙醇使用中有较多不良反应;另外,肿瘤坏死组织周围呈现纤维组织增生包绕癌细胞巢(图4②),这可认为增生的纤维组织可间隔肿瘤与周围组织。这提示我们,可考虑在今后实验研究中除了在瘤体中央注入聚桂醇,在瘤体周围也注射聚桂醇,使之促进纤维增生,起到阻断肿瘤血供及抑制肿瘤细胞向外浸润的作用,为应用于人体肿瘤提供病理学依据。
图4 聚桂醇组病理学检查图像
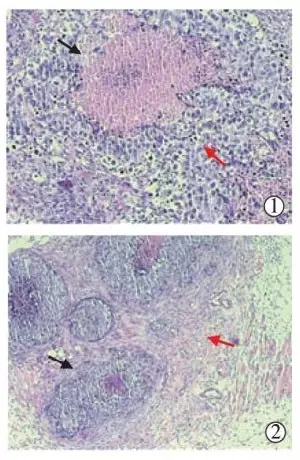
①黑色箭头所指为坏死区,红色箭头为无明显损伤癌细胞;
②黑色箭头所指为癌细胞巢,红色箭头为纤维组织包绕
本实验结果提示,聚桂醇具有杀伤肝癌细胞作用,且可使肝癌结节明显缩小;治疗肝癌方面效果与无水乙醇疗效相似,却没有无水乙醇引起的各种不良反应,因此可作为无水乙醇替代硬化剂使用。
