J South Med Univ2016, 36(12): 1694-1699
良性甲状腺囊肿超声引导聚桂醇硬化治疗效果及其相关因素分析
陈志江,王龙,黄怡静,赖水青,陈红梅,裴剑浩,丛淑珍,邝建
(广东省人民医院内分泌科 广东广州 510080)
摘要:
目的:分析良性甲状腺囊肿超声引导聚桂醇硬化的治疗效果及其主要影响因素,探讨适合聚桂醇硬化治疗的甲状腺囊肿类型。
方法:97例共99个囊腔体积≥2cm3并经细胞病理诊断为良性的甲状腺囊肿,采用超声引导下聚桂醇硬化治疗,分别在术后1,3,6,12月进行随访。囊肿按病程、囊液成分、囊液粘稠度、囊实性比例、囊壁厚薄、囊腔分隔进行分类。疗效评价按囊腔体积缩小<50%为无效,缩小≥50%为有效,缩小≥90%为治愈。
结果:囊肿基线及治疗后1,3,6,12月的体积分别为12.08±11.56cm3、5.63±8.51cm3、5.96±8.42cm3、3.80±5.50cm3、2.85±3.98cm3;平均囊腔体积缩小(70.0±33.7)%;累积有效率为82.8%(82/99),治愈率为63.6%(63/99);13.1%(13/99)囊肿因1~3个月后较基线增大或无缩小需要再次硬化治疗,病程1年以上的囊肿是导致多次硬化的独立因素[23.7%(9/38)vs6.6%(4/61),OR=4.473(1.238~16.169),P=0.022];治疗效果与囊腔分隔、囊液粘稠度、囊实性比例、囊壁厚度相关;COX多因素回归分析显示影响囊肿最终疗效(缩小<90%)的主要因素是囊腔分隔(HR=2.25,95%CI1.19~4.25)和囊液粘稠(HR=2.02,95%CI1.19~3.43)。
结论:超声引导穿刺聚桂醇硬化治疗术可有效安全地治疗良性甲状腺囊肿,6个月可达到最大治疗效果,对病程1年以下、囊液稀薄、囊腔无分隔的单纯囊肿治疗效果最佳。
关键词:
甲状腺囊肿;硬化治疗;聚桂醇
文献编号:
doi:10.3969/j.issn.1673-4254.2016.12.18
甲状腺结节是临床常见病和多发病,通过触诊患病率只有4%~7%[1-2],成人人群中通过超声诊断甲状腺结节的约占20%~76%[2-3],而甲状腺囊肿约占甲状腺结节的15%~30%,尽管绝大多数为良性[4],但由于外观和局部压迫等原因,常需要临床治疗。单纯抽液简单经济,但复发率高;手术切除可以根治囊肿,但存在一定的手术风险和费用较高;穿刺硬化治疗是简单有效的临床治疗方法,国外主要使用无水乙醇作为囊肿硬化剂[5-7],国内由于各种原因无法常规开展和应用。聚桂醇作为血管硬化剂,近年来逐渐应用于甲状腺囊肿的硬化治疗,国内外少量研究报道[9-13]显示聚桂醇硬化治疗对甲状腺囊肿有良好的有效性和安全性,但治疗方式、治疗效果等存在差异,同时甲状腺囊肿有多种临床类型和特征,目前尚缺乏聚桂醇对不同类型甲状腺囊肿的疗效分析。本文总结近两年来我们内分泌科独立完成的良性甲状腺囊肿超声引导聚桂醇硬化治疗随访结果,分析不同类型囊肿的治疗效果差异,探讨适合聚桂醇硬化治疗的良性甲状腺囊肿类型。
一、 资料与方法
1.1 研究对象
2014年7月~2016年3月期间,97例患者(男26例,女71例)经超声检查发现甲状腺囊性结节,共99个囊肿(单纯囊肿44个和囊实性55个),囊腔体积大小均在2 cm3以上。经病史询问、体格检查和实验室检测,均无严重的心、肺及肝肾功能不全、 凝血功能障碍等疾病,穿刺前2周内无服用阿司匹林、华法林等影响凝血功能药物。在超声引导下,行囊肿穿刺抽液、细胞学病理检查和聚桂醇硬化治疗。所有囊性结节的细胞病理学结果均为良性。
1.2 仪器与方法
1.2.1 仪器与药物 超声引导用加拿大 SonixSP型彩色超声多普勒超声诊断仪, 高频线阵探头(L14-5);定制的一次性静脉留置针(18 G×45 mm,威海洁瑞医用制品有限公司);吸引活检针 22 G×5 cm/8 cm (意大利gallini,PA22/8、 PA22/5)或 23G×50 mm/70 mm(日本八光);硬化剂为聚桂醇注射液(陕西天宇制药公司,100 mg/10 mL/支)。
1.2.2 术前检查 记录患者的病程,症状和体征,完善甲状腺功能,甲状腺球蛋白(TG),抗甲状腺过氧化物酶抗体(TPO-ab),甲状腺球蛋抗体(TG-ab),降钙素(sCT),血常规,凝血指标等检查。在内分泌诊疗室,再次行甲状腺超声测量,根据囊肿长(cm)×宽(cm)×厚(cm)×π/6计算囊肿体积(cm3),并测量囊壁的厚度,观察囊实性的比例,囊腔分隔情况等。
1.2.3 穿刺与硬化治疗 患者取仰卧位,垫高肩部,颈部适当后仰,以暴露颈部, 常规消毒铺巾,超声探头包裹无菌保护套。3~4支10 mL注射器分别抽取聚桂醇注射液2~4 mL,备用。超声定位后,穿刺点2%利多卡因局部皮下浸润麻醉。定制的一次性静脉留置针连延长管接10 mL注射器,在超声引导下,进针达囊肿内部, 1~2 mL负压缓慢抽出囊液,观察囊液的量,颜色、粘稠度,抽出液分别做薄层液基细胞学检查和甲状旁腺素检测。若为囊实性结节,则先用吸引活检针在实性部分多点吸取细胞, 做细胞学涂片或薄层液基细胞学检查。若细胞学病理发现异型或恶性细胞,硬化术后改外科手术治疗;囊液甲状旁腺素显著升高者, 诊断为甲状旁腺囊肿,均未纳入本研究。
硬化治疗:超声引导下,调整留置针的方向和部位,抽出囊液剩留0.5~1 mL, 根据囊腔分隔与否,决定是否拔出针芯,换含聚桂醇注射器在囊内多个方向反复冲洗置换囊液,更换聚桂醇注射器,直至冲洗液颜色变清亮,最后囊内保留约为抽出液1/10~1/3的聚桂醇,术毕。对于胶质等囊液粘稠难以抽出的囊肿,予聚桂醇或5%碳酸氢钠溶液1~2 mL注入囊腔内溶解约1~2 min后2~4 mL负压抽吸, 操作时不拔出针芯, 以调整针尖角度和部位,如此多次、 多部位溶解和抽吸后, 再用聚桂醇冲洗和置换。术中尽量减少穿刺次数和高负压或快速抽吸, 避免囊内出血。穿刺前嘱患者在治疗过程中尽量避免吞咽、说话、 咳嗽。术后局部加压10 min, 观察30 min, 无不适后离院,并在1月内尽量避免颈部受压、用力吞咽或咳嗽。
1.2.4 随访和疗效评价 术后1、 3、 6、 12月回内分泌专科随访, 超声测量甲状腺囊腔大小变化。若治疗后1~3个月囊肿较基线增大或无缩小, 则行第2次硬化治疗。
治疗效果评价包括甲状腺整体囊肿以及囊腔体积与基线相比的变化; 囊腔体积缩小<50%定义为无效,缩小≥50%为有效,缩小≥90%以上为治愈。
1.2.5 囊肿类型定义 病程按病史分为1年以内、1年或以上;囊液成分按血性的和非血性分类;囊液性质分为粘稠和非粘稠 (超声定位针尖在囊内且无异物堵塞情况下,1 mL的负压能顺利抽吸囊液的为非粘稠,不能顺利抽吸的为囊液粘稠); 囊肿构成分为囊性结节(实性部分在10%或以下)和囊实性结节(实性部分在10%以上的);囊壁厚度分为厚囊壁(超声下囊壁厚度>1 mm),薄囊壁(囊壁厚度≤1 mm); 囊腔分隔分为有分隔和无分隔。
1.3 疗效评价[6]
采用SPSS 20.0进行统计学分析,计数资料使用卡方检验;计量资料用均数±标准差表示,前后比较采用配对t检验,组间比较用单因素方差分析;多次硬化的相关影响因素分析用二元Logistic后向条件法回归分析, 疗效相关因素分析采用COX单因素和多因素后向条件法回归分析。P<0.05表示差异有统计学意义。
二、 结果
2.1 一般资料
97例患者(男性26人,女性71人),年龄14~71岁,平均 46.48 ± 12.85 岁;总体甲状腺囊肿基线体积为12.06±11.51 cm3,中位数为8.09 cm(3 2.15~68.94 cm3),其中,男性17.38±16.87 cm(3 中位数11.90,2.15~68.94 cm3),女性10.19±8.33 cm(3 中位数7.41,2.36~40.77 cm3)。甲状腺相关指标均正常。男性患者的年龄和囊肿体积均显著大于女性 (P<0.006,表1)。
99 个囊肿中86个只需行1次硬化治疗,13个(13.1%)囊肿因在1或3个月时较基线增大需要或无缩小再次硬化治疗(9个2次,4个3次),共116次硬化治疗。平均随访6.47±3.64月。
2.2 疗效分析
囊肿基线及治疗后 1、3、6、12个月的体积分别为12.08 ± 11.56、5.63 ± 8.51、 5.96 ± 8.42、3.80 ± 5.50 cm3,2.85±3.98 cm3,各次随访囊肿体积与基线相比有显著统计学差异(P<0.001),体积缩小59.5%~68.6%。累计囊腔体积缩小(70.0±33.7)%。治疗前后囊肿体积配对T检验显示,治疗后1、3、 6、12各月的囊肿体积分别缩小-6.30±8.79、-7.72±10.74、-7.75±8.76、 -7.03±6.38 cm3,P值均<0.001。治疗后第6月与第 3个月相比,囊腔体积仍有显著缩小(V3-V6,2.08±5.73 cm3,t=2.06,P=0.045),但与第12个月相比无显著差异(V6-V12,0.34±2.55,t=0.59,P=0.56),提示硬化治疗后6个月达到最大疗效。单次硬化治疗的有效率 82.6%(71/86),治愈率66.3% (57/86),2次硬化的9个囊肿有效率77.8%(7/9),治愈率33.3%(3/9),3次硬化的 4个囊肿有效率 100%(4/4), 治愈率 50.0%(2/4)。硬化治疗最终有效率为82.8% (82/99),治愈率为63.6% (63/99),男女的疗效无显著差异。需要多次硬化治疗的囊肿主要特征是病程1年以上 [23.7% (9/38)vs 6.6% (4/61), t=6.021, P=0.029]; 囊壁厚[17.6%(12/68)vs 3.2%(1/31), t=3.882,P=0.058]。Logistic多元回归分析提示,病程1年以上的囊肿是导致多次硬化的主要独立影响因素[OR=4.473(1.238-16.169),P=0.022]
2.3 疗效相关因素
囊腔基线体积对治疗效果未见影响(治愈vs 未治愈10.71±10.94 vs14.37±12.35,F=2.354, P=0.128; 有效vs无效 12.14± 11.92 vs 11.79± 9.96,F=0.013,P=0.909)。
单因素卡方检验,有效率的影响因素主要是囊腔分隔(P<0.001),囊壁厚薄有边缘差异 (P=0.056);治愈率则受多种因素显著影响,包括囊液粘稠、囊实性、 囊壁厚薄和囊腔分隔(表2)。
COX回归分析中,对于有效率,各因素的单因素分析均无显著影响,多因素后向条件回归方程纳入囊液粘稠和囊腔分隔两个因素,但均未达统计显著性(囊液粘稠,HR=1.465,P=0.093;囊腔分隔,HR=1.613,P=0.066);对于治愈率, 单因素分析中囊液粘稠、囊实性和囊腔分隔均有显著影响,多因素分析提示囊液粘稠 (HR值2.066,95% CI 1.221-3.497,P=0.007) 和囊腔分隔 (OR值2.298,95% CI 1.220-4.330,P=0.010)是主要的独立影响因素(表2)。
2.4 不良反应
97例患者中仅2例硬化过程中诉局部有轻度灼热感(2.0%),均在10 min内自行缓解,发声困难,声音嘶哑,面色潮红等症状。另有2例硬化治疗后当天或次日出现低热,无经特殊处理后自行缓解,考虑与药物治疗相关。
三、 讨论
甲状腺囊肿是临床常见的甲状腺病变。大多数是由于结节性甲状腺肿或甲状腺腺瘤发生退行性变、出血、或缺血坏死液化所致,部分为甲状腺腺瘤滤泡相互融合而形成, 极少数来源于甲状腺舌导管或鳃后体残余,或甲状腺癌出血、坏死所致。绝大部分甲状腺囊肿为良性病变,恶性率约0.5%~3% [14]。
甲状腺囊肿治疗与否和治疗方法取决于囊肿的良恶性质和体积大小。对于良性的甲状腺囊肿,基本在出现局部压迫症状和外观影响才需要治疗。有指南建议直径≥1.5~2.0 cm 时才需行超声引导细针穿刺病理(US-FNA)或治疗[14]。目前的治疗手段包括了单纯抽液、硬化治疗、外科手术切除和化学或物理消融等。单纯的抽液治疗复发率高(60%~90%),尤其在重复抽吸和囊肿体积较大的囊肿[5]; 外科手术切除和物理消融(射频、微波、激光等)适合于显著增大的复杂性或反复复发的囊肿,治疗费用较高,有一定的手术风险。化学消融(无水酒精)和药物硬化治疗简单易行、费用低廉和治疗效果良好而日益得到临床应用。其中,同时用于实性结节化学消融的无水乙醇在国外应用最为广泛 [7,19],国内由于多种原因并未得到常规开展和应用。其他目前有临床报道的甲状腺囊肿硬化治疗药物包括:氟美松、鱼肝油酸钠、高糖、盐酸精氨酸、OK-432、四环素、聚桂醇及无水乙醇等。
聚桂醇(聚氧乙烯月桂醇醚)作为血管硬化剂,可直接损伤血管内皮,促进血栓形成,阻塞血管,继而局部炎症反应和血管组织纤维化而永久闭塞。囊肿腔内注射聚桂醇后,在清洁囊内壁的同时破坏内膜细胞,减少囊液渗出并产生黏连, 继而纤维化闭塞囊腔,达到硬化治疗目的。已多年应用于血管瘤、内痔、静脉曲张、腱鞘、 肝、肾囊肿等的硬化治疗[8,20-21]。最新的动物实验显示,聚桂醇所致局部甲状腺组织纤维化不影响甲状腺功能和导致甲状腺与周围组织粘连 [15]。同时, 国内外临床研究显示聚桂醇作为硬化剂,用于甲状腺囊肿硬化治疗具有良好的安全性和有效性 [9-13]。此外, 聚桂醇也是一种作用轻微的局麻剂, 有局部镇痛作用,相比无水乙醇具有局部刺激小,不良反应更低的优势 [8]。
图1 甲状腺囊肿的不同超声声像特征
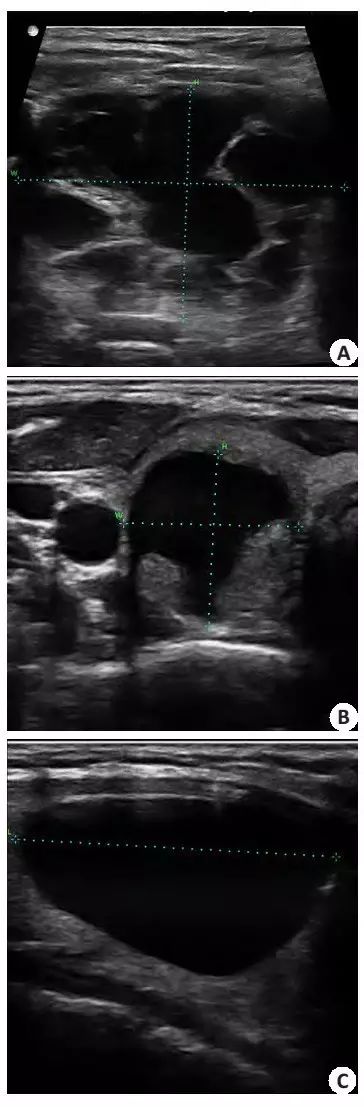
在本随访总结中, 超声引导下聚桂醇硬化治疗对良性甲状腺囊肿有良好的治疗效果:单次硬化治疗即可达到有效率82.6%,治愈率66.3%,只有约13%的囊肿需要2次以上的重复治疗。治疗效果与国内已有的几个研究报道相似。在这些研究中, 有效率介于84.6%~95.5%,治愈率52.6%~89.1%, 但需要重复治疗的比例在24.1%~64.1%,显著高于我们的13.1%再治疗率。这可能与临床治疗模式、囊肿类型、以及实际临床操作的差异有关,有研究采用每周复查和治疗1次的方式 [10],其他研究则多为单纯性囊肿,在3个月后复查,根据效果再考虑是否再次治疗。
在本组病例中,需要多次穿刺硬化的囊肿特征主要是囊壁较厚,尤其是病程 1年以上的长病程囊肿。另外,在穿刺硬化治疗过程中,进针部位血流丰富、进针次数越多、抽液时负压过大,都可能增加囊内出血风险,影响治疗效果。我们在临床实践中发现,穿刺过程中,选择血流少的穿刺部位、尽量减少进针次数、 避免过大负压、快速抽液以及冲洗时避免过大压力,可以减少囊内出/渗血风险。治疗结束后观察15~30 min,囊肿没有较前增大,即可在1个月后复查。治疗过程中少量的囊内出/渗血一般在1~3个月后自行吸收,多数囊肿可在1个月后缩小近60%。因此,每周复查和再次硬化治疗似乎并无必要,3个月才复查又可能延缓了再次治疗的时间。治疗后1、3、6、12个月复查,之后每年复查较为合适。
在本研究和已有研究报道中,囊肿缩小超过50%的有效率在80%以上。但囊肿消失或缩小90%以上的治愈率介于50%~70%。而甲状腺囊肿的病因多种,临床表现也有多种类型,如出血性和胶质性囊肿、 单纯性囊肿和囊实性囊肿,多分隔性囊肿等。本数据分析显示,不同临床和超声特征的甲状腺囊肿,对聚桂醇硬化治疗效果有不同的影响:(1)对于囊腔缩小50%以上的治疗效果而言,聚桂醇硬化治疗效果显著,并不受上述因素影响;(2)对于囊腔缩90%以上甚至消失的治疗效果,囊液粘稠、囊实性、囊壁厚和囊腔分隔是其影响因素,其中的囊液粘稠和囊腔分隔是最主要和独立的影响因素。
对于囊实性、囊壁厚和多分隔囊肿, 超声影像中常见囊壁和/或囊内丰富血流, 结合囊液颜色和性质,多是结节出血所致。这些囊肿,在硬化治疗过程中和治疗后, 极易出现术中或术后再出/渗血。其中,多分隔囊肿在治疗过程中常需要囊内多角度穿刺和部位调整, 容易出血外,还受难以完全抽出囊液和充分聚桂醇冲洗硬化的影响, 导致治疗效果难以保证。国内外应用无水乙醇治疗时, 也发现囊腔分隔会影响硬化剂的扩散, 不能保证每个囊腔均充分硬化, 而实性部分深层难以完全硬化,从而影响最终疗效[7,16-17, 22-23]。
粘稠的囊液多为胶质、陈旧性出血或两者同时存在。由于囊液粘稠,穿刺抽液时常需要较大负压或较粗的穿刺针才能缓慢抽出甚至完全不能抽出。国内有学者研发了一种穿插针,在较粗的PTCA针身旁开一个5 mm×1 mm的侧窗,临床应用提示可以很好的解决粘稠囊液的抽取问题[18]。而我们在临床治疗中,发现聚桂醇和5%碳酸氢钠对粘稠囊液有一定的溶解作用,在进针发现囊液粘稠后,先用1~2 mL聚桂醇或5%碳酸氢钠溶液缓慢注入囊腔内溶解约1~2 min后2~4 mL负压缓慢抽吸,并在囊内调整针尖角度和部位,如此多次、多部位溶解和抽吸,基本上可达到近乎完全抽吸的效果,然后再用聚桂醇冲洗和留置,也可取得良好的效果,只是用时较长、操作需要耐心和细致。因此,在治疗过程中,掌握恰当的治疗技术对疗效和减少再次治疗非常重要。
对于多次聚桂醇硬化治疗复发,或多分隔、实性比例>50%的良性甲状腺囊肿,我们部分病例在抽液后直接用射频消融治疗,治疗效果显著。国外对无水乙醇消融不佳患者改用射频消融也证实可取得良好的效果[24]。
总结而言,对于良性甲状腺囊肿,超声引导下的聚桂醇硬化治疗有良好的治疗效果,副作用极少,同时经济、简单。尤其对于囊壁薄、粘液稀薄、无囊内分隔的单纯性囊肿治疗效果最佳;而病程较长、囊肿周围血流丰富、实性比例大、囊内分隔多的囊肿,需要多次治疗的几率较大,采用抽液后射频/微波消融治疗或直接外科手术的效果应更合适。




