发布时间:2020-11-30 16:40:51 来源: 浏览次数:1085
《临床皮肤科杂志》2020年49卷第3期
金轶,丁帆,成仙叶,李谢伦,陈斌
(南京医科大学第一附属医院皮肤科,江苏南京210029)
摘要:
目的:利用Meta分析系统评价聚桂醇注射治疗皮肤血管瘤和静脉畸形的疗效及安全性。
方法:计算机检索MED-LINE、CochraneLibrary、PubMed、中国知网(CNKI)、维普(VIP)期刊全文及万方电子期刊全文数据库,检索所有关于聚桂醇注射治疗血管瘤和静脉畸形的随机对照研究,文献检索日期截止至2019年4月1日。对最终纳入的所有研究进行质量评价,使用RevMan5.3软件进行Meta分析。
结果:共纳入17个随机对照研究,1399例皮肤血管瘤和静脉畸形患者。结果显示,聚桂醇治疗血管瘤或静脉畸形的有效率和安全性均高于平阳霉素;聚桂醇治疗血管瘤的有效率和安全性与口服普萘洛尔组相比,差异均无统计学意义;聚桂醇联合平阳霉素治疗血管瘤或静脉畸形的有效率和安全性均高于单独使用平阳霉素;聚桂醇联合口服泼尼松治疗血管瘤的有效率高于单独口服泼尼松;聚桂醇联合脉冲染料激光(PDL)治疗血管瘤的有效率高于单独使用PDL,但2者不良反应率相比,差异无统计学意义。
结论:聚桂醇注射治疗皮肤血管瘤和静脉畸形均有较好的有效性及安全性,聚桂醇单独用药或联合用药时均有确切的疗效。
关键词:
聚桂醇;血管瘤;静脉畸形;疗效;安全性
文献编号:
血管瘤是一种常见的血管增生性肿瘤,分为婴幼儿血管瘤、先天性血管瘤、丛状血管瘤、卡波西形血管内皮瘤及梭状细胞血管内皮瘤[1]。大多数血管瘤,尤其是婴幼儿血管瘤,有自行消退的倾向,但当病变引起严重溃疡、出血及永久性毁容或破坏重要结构、影响呼吸或导致心力衰竭时,通常需要临床早期干预[2]。目前血管瘤的主要治疗方法包括口服糖皮质激素或β受体阻滞剂[3]、病灶内注射糖皮质激素或硬化剂、外用β受体阻滞剂、激光及手术切除等,其中皮损内注射硬化剂治疗血管瘤的报道近年来逐渐增多[4]。
脉管畸形分为毛细血管畸形、静脉畸形、淋巴管畸形、动静脉瘘、动静脉畸形等,其中静脉畸形最为常见[1]。静脉畸形,旧称海绵状血管瘤,是静脉异常发育产生的静脉血管结构畸形[1]。超过40%的血管瘤和静脉畸形发生在头部和颈部[5]。静脉畸形常在出生时就存在,但通常不明显,多为低流量的血管异常。由于低流量静脉囊随着静脉血的停滞而逐渐扩大,因此静脉畸形通常不会自动消退[6]。随着静脉畸形的扩张,瘀血和血栓形成可导致肿胀和疼痛[7]。当眼眶、口腔或其他重要部位受累时,会产生不同程度的功能障碍,因此静脉畸形需要临床治疗。静脉畸形目前主要治疗方法包括手术切除和皮损内注射治疗,其中皮损内注射治疗包括传统的糖皮质激素注射和硬化疗法。
硬化疗法是指硬化剂通过某种途径被注射入病灶后使瘤体内产生无菌性炎症、局部结缔组织增生和纤维化,最终使瘤体萎缩直至消退的方法[8]。聚桂醇,又名聚多卡醇,是中国自主研制的一种泡沫硬化剂,与进口药物聚多卡醇成分一致。它通过破坏血管内皮细胞,使作用部位的血小板、红细胞及纤维蛋白聚集沉积,形成血栓并阻塞血管,进而破坏异常的血管通道[8]。聚桂醇不仅对血管瘤和脉管畸形疗效确切,对体表和脏器囊肿、静脉曲张、食管-胃底静脉曲张及内痔等均显示良好的疗效[6,9]。聚桂醇原液或泡沫剂均可用于硬化疗法,但多数文献中推荐聚桂醇泡沫剂。与原液相比,泡沫剂疗效更显著[10-11]。目前为止很少有研究系统地综述聚桂醇治疗皮肤血管瘤和静脉畸形(不包括内脏和消化道血管瘤和静脉畸形)的有效性和安全性。因此,本文通过收集已发表的有关于聚桂醇注射治疗血管瘤和静脉畸形的数据,将聚桂醇与其他治疗方法进行比较,对现有的文献进行总结和Meta分析。
一、资料与方法
1.1 文献检索
计算机检索MEDLINE、Cochrane Library、PubMed、中国知网(CNKI)、维普(VIP)期刊全文及万方电子期刊全文数据库,并检索纳入文献的参考文献,防止漏查。检索时间截止至2019年4月1日。检索词包括聚桂醇、聚多卡醇、血管瘤及静脉畸形。
1.2 纳入和排除标准
纳入标准:①研究对象:患有皮肤血管瘤或静脉畸形的患者;②研究类型:随机对照试验(RCT);③试验组的干预措施为聚桂醇(或聚多卡醇)或联合常规治疗;对照组的干预措施为常规治疗,包括局部注射平阳霉素、口服或外用β受体阻滞剂、口服糖皮质激素、局部激光治疗及局部注射无水乙醇等;④记录结局指标包括治疗有效率和(或)不良反应发生率;⑤原始文献资料为已公开发表的中、英文文献。
排除标准:①重复发表的文献;②研究内脏和消化道的血管瘤和静脉畸形的文献;③系统回顾和荟萃分析、综述文章、会议摘要及病例报告。
1.3 数据提取和质量评估
文献筛选、资料提取和质量评价均由2位研究者独立完成,交叉核对,分歧通过讨论后以协商一致方式解决。依据上述纳入和排除标准,2位研究者阅读题目和摘要后对每篇文献进行独立评价,排除不符合纳入标准的文献后,对入选文献进一步阅读全文,确定最终是否纳入。收集信息包括第一作者姓名、发表年份、干预组和对照组的有效例数、不良反应发生例数、总例数、聚多卡醇剂型及记录的结局指标等。所有的信息均按照事先统一制定的表格来收集(表1)。使用Cochrane协作网工具对纳入的研究进行质量评价,内容包括:随机序列的产生、分配隐藏、参与者与实施者盲法、测量盲法、结果数据的完整性、选择性报告结果及其他偏倚等。
1.4 统计学方法
采用Cochrane协作网提供的Revman5.3软件进行统计学分析。各临床试验的异质性检验采用χ2检验。若异质性检验无显著性差异(I2<50%),Meta分析则选用固定效应模型;若有异质性(I2≥50%),则寻找可能产生异质性的原因,对可能导致异质性的因素进行亚组分析;若各研究间仅存在统计学异质性而无临床异质性或差异无临床意义时,则选择随机效应模型进行Meta分析。所有数据均采用比值比(OR)分析,并进行95%可信区间(CI)估计。当OR=1或其95%CI包含1,等价于P>0.05,即无统计学意义;若其上下限不包含1,等价于P<0.05,即有统计学意义。发表偏倚利用RevMan5.3软件的漏斗图来评价[12]。当样本量较大时,数据可信度高,散点分布于漏斗尖上;当样本量较小时,数据可信度差,散点分布于漏斗底。
2.结果
2.1 文献检索结果
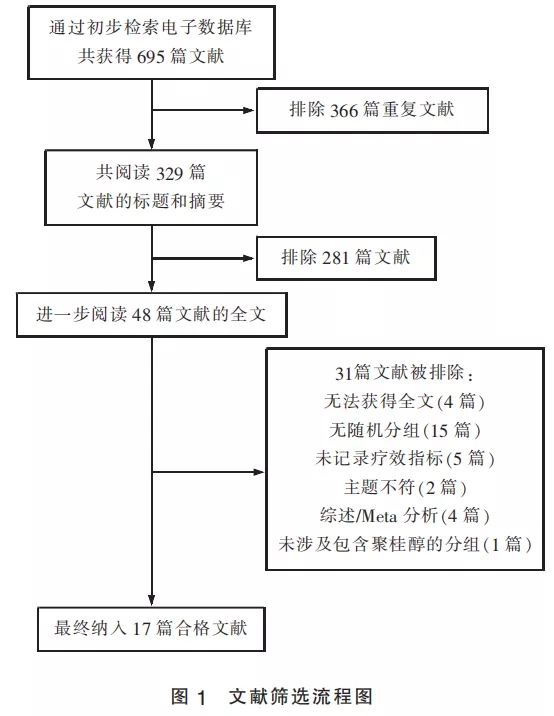
从MEDLINE、Cochrane Library、PubMed、CNKI、VIP期刊全文及万方电子期刊全文数据库共初步检索到695篇文章。排除重复文献后共计所得329篇文献。按照纳入和排除标准,通过对文献的标题和摘要进行评价,共排除281篇文献。继续对筛选所得研究进行全文评价,排除31篇文献,最终选出合格文献17篇,纳入本Meta分析(图1)。
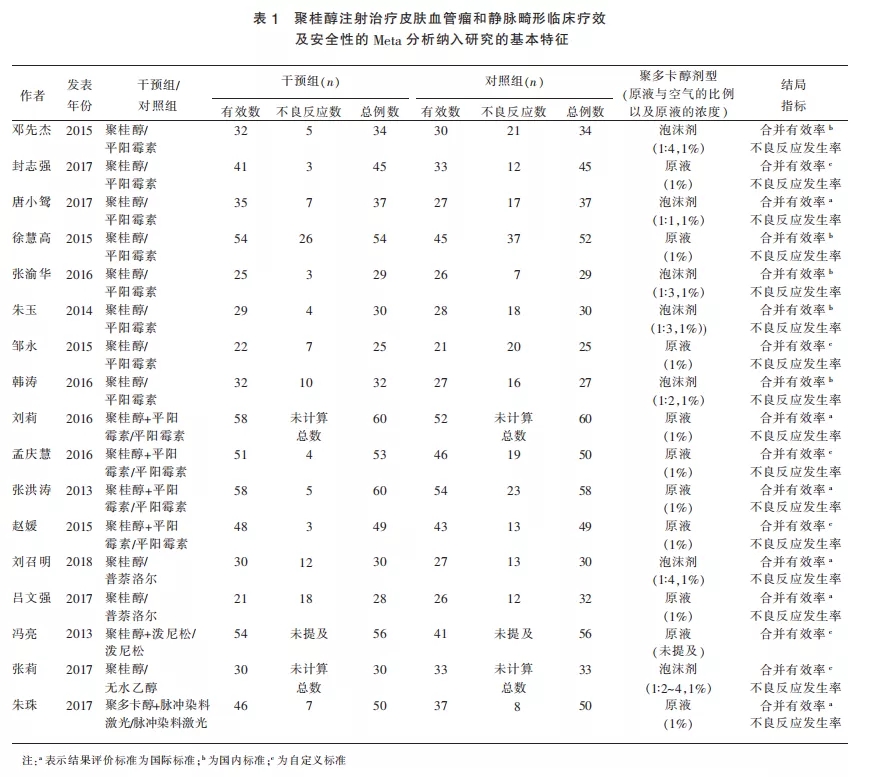
2.2 纳入研究的基本特征
最终纳入的研究均为2013年至2019年期间在中国进行的随机对照研究。所有文献均被评为低质量,主要原因是对随机或盲法无明确描述或纳入例数偏少等。纳入的17项研究,共计1399例患者,均使用聚桂醇为主要干预措施,平均治疗时间1~6次不等,平均临床随访时间4周~12个月,其中15项研究描述了血管瘤或静脉畸形的发病部位,2项研究缺乏该项报告。
在纳入的研究中,有11篇文献的干预组为单独使用聚桂醇,对照组分别为平阳霉素[13-20]、无水乙醇[21]、普萘洛尔[22-23]。其中374例患者单独使用聚桂醇,496例患者单独使用平阳霉素,62例患者单独使用普萘洛尔,33例患者单独使用无水乙醇。
6篇文献的干预组为联合干预措施,分别为聚桂醇联合平阳霉素[24-27]、聚桂醇联合脉冲染料激光(PDL)[28]和聚桂醇联合泼尼松[29],对照组分别为单独使用平阳霉素、PDL或泼尼松。其中222例患者联合使用聚桂醇与平阳霉素,50例患者联合使用聚桂醇和PDL,56例患者联合使用聚桂醇与泼尼松,217例患者单独使用平阳霉素,50例患者单独使用PDL,56例患者单独使用泼尼松。
7项研究中使用聚桂醇泡沫剂(1∶2~1∶4混合空气);10项研究中使用聚桂醇原液(1%浓度)。尽管没有统一的疗效评价标准,但所有研究均通过评估病变大小、颜色或厚度来评价聚桂醇疗效。仅1篇文献没有对聚桂醇的安全性进行评价,其余16项研究均详细报告了使用聚桂醇局部注射治疗皮肤血管瘤或脉管畸形的不良反应。
所有纳入研究均报告有效率。6篇研究的疗效评价采用Achauer等[30]提出的4级标准进行疗效评价,即Ⅰ级:差,瘤体缩小≤25%;Ⅱ级:中,瘤体缩小25%~50%;Ⅲ级:好,瘤体缩小50%~75%;Ⅳ级:优,瘤体缩小>75%。有效率=(Ⅳ级+Ⅲ级+Ⅱ级)/总例数×100%。5篇研究采用国内标准[31]进行疗效判定,以注射后瘤体基本消失、皮肤色泽基本恢复正常,肢体无功能障碍为显效;注射后瘤体明显缩小,但缩小幅度<70%,皮肤色泽与正常皮肤存在明显色差为有效,需继续治疗;治疗前、后瘤体体积无明显变化或继续增大,则判定为无效。有效率=显效率+有效率。其余研究采用自定义疗效评价标准。
纳入分析的17项研究的详细特征见表1。
2.3 聚桂醇注射治疗血管瘤或血管畸形的临床疗效
纳入的17篇研究中,基于对照组不同,分为6个亚组进行比较分析:Ⅰ组,聚桂醇与平阳霉素的比较;Ⅱ组,聚桂醇与普萘洛尔的比较;Ⅲ组,聚桂醇与无水乙醇的比较;Ⅳ组,聚桂醇联合平阳霉素与单独使用平阳霉素的比较;Ⅴ组,聚桂醇联合泼尼松与单独使用泼尼松的比较;Ⅵ组,聚桂醇联合PDL与单独使用PDL的比较。
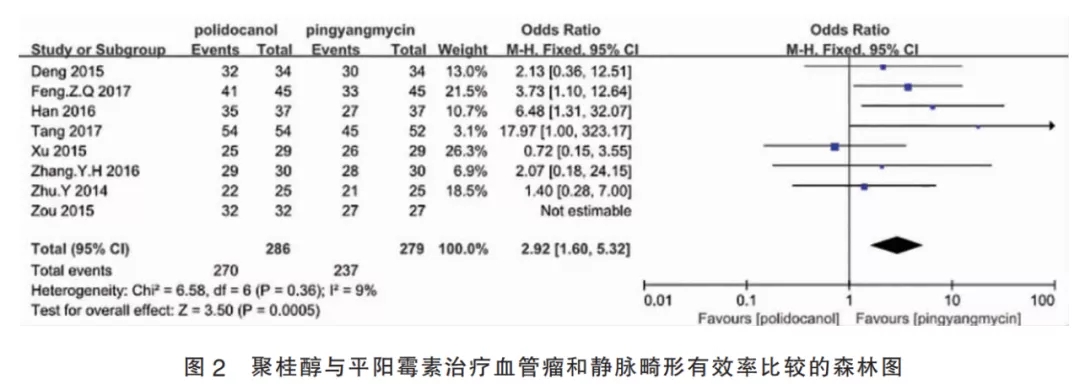
2.3.1 聚桂醇与平阳霉素比较(Ⅰ组)的合并有效率该组纳入8篇研究,I2=9%,故采用固定效应模型进行Meta分析。聚桂醇组共纳入患者286例,平阳霉素组共纳入患者279例,合并效应量OR=2.92,95%CI[1.60,5.32],合并效应量检验为P<0.001,差异有统计学意义,表明聚桂醇注射治疗皮肤血管瘤或静脉畸形的有效率高于平阳霉素对照组(图2)。
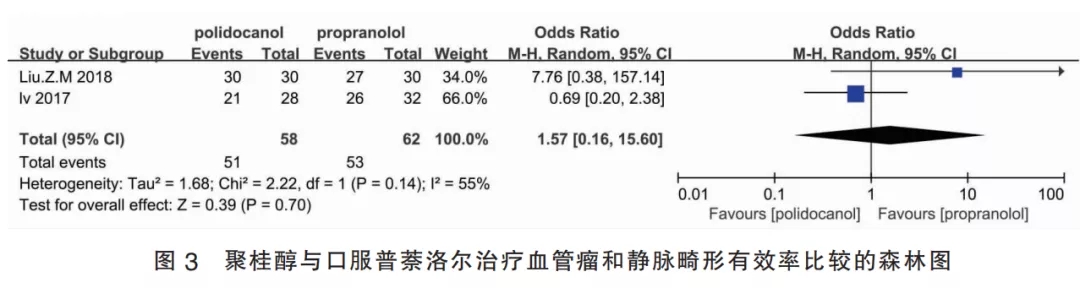
2.3.2 聚桂醇与口服普萘洛尔比较(Ⅱ组)的合并有效率该组纳入2篇研究,I2=55%,故采用随机效应模型进行Meta分析。聚桂醇组共纳入患者58例,普萘洛尔组共纳入患者62例,合并效应量OR=1.57,95%CI[0.16,15.60],合并效应量检验为P=0.700,差异无统计学意义,表明聚桂醇注射治疗皮肤血管瘤有效率与口服普萘洛尔对照组无明显差异(图3)。
2.3.3聚桂醇与无水乙醇比较(Ⅲ组)的合并有效率该组纳入1篇研究,该研究将患者随机分为聚桂醇组和无水乙醇组,聚桂醇组为30例,无水乙醇组为33例。根据文献报道,经过2次治疗后,2组的合并有效率为100%,无法进行Meta分析。
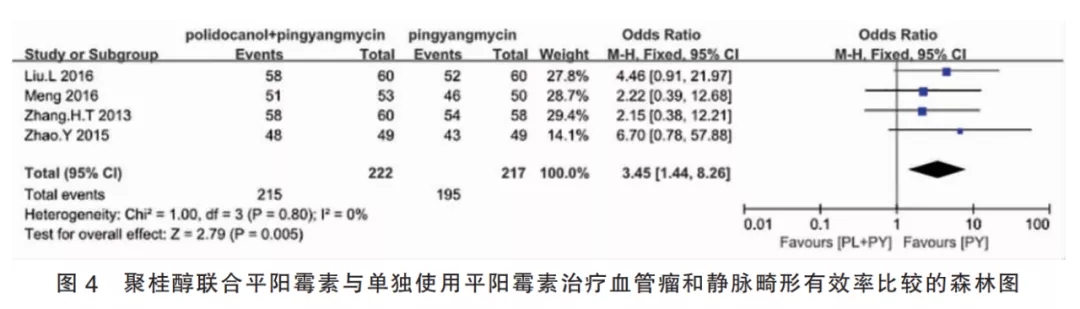
2.3.4聚桂醇联合平阳霉素与单独使用平阳霉素比较(Ⅳ组)的合并有效率该组纳入4篇研究,I2=0%,故采用固定效应模型进行Meta分析。聚桂醇组共纳入患者222例,平阳霉素组共纳入患者217例,合并效应量OR=3.45,95%CI[1.44,8.26],合并效应量检验为P=0.005,差异有统计学意义,表明聚桂醇联合平阳霉素治疗皮肤血管瘤或静脉畸形的有效率高于单独使用平阳霉素对照组(图4)。
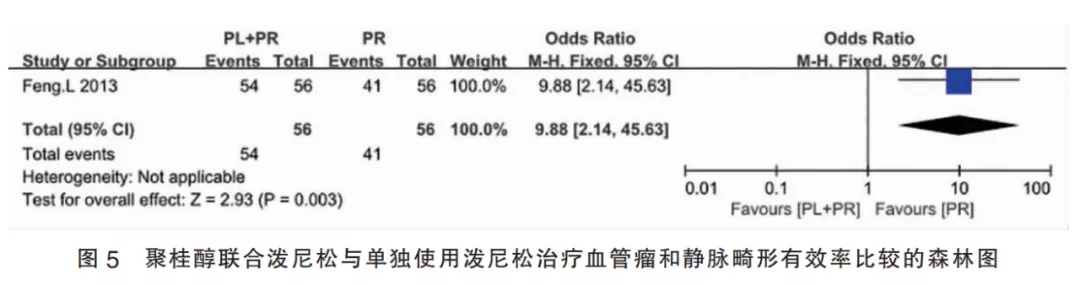
2.3.5聚桂醇联合泼尼松与单独使用泼尼松比较(Ⅴ组)的合并有效率该组纳入1篇研究,该研究将患者随机分为试验组和对照组,每组56例。合并效应量OR=9.88,95%CI[2.14,45.63],合并效应量检验为P=0.003,差异有统计学意义,表明聚桂醇注射联合口服泼尼松治疗皮肤血管瘤有效率高于单独口服泼尼松(图5)。
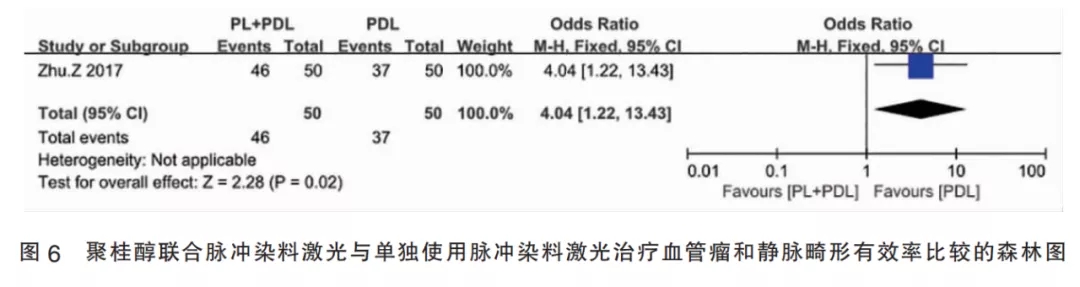
2.3.6聚桂醇联合PDL与单独使用PDL比较(Ⅵ组)的合并有效率该组纳入1篇研究,该研究将患者随机分为试验组和对照组,每组50例,试验组使用聚桂醇联合PDL,对照组单独使用PDL。合并效应量OR=4.04,95%CI[1.22,13.43],合并效应量检验为P=0.020,差异有统计学意义,表明聚桂醇注射联合PDL治疗皮肤血管瘤的有效率高于单独使用PDL(图6)。
2.4 聚桂醇局部注射治疗血管瘤或血管畸形的安全性分析
共有17篇入组文献报道了不良反应的相关数据。2篇文献提供的数据无法进行数据合并,2者均分别描述各类不良反应的例数,存在重复计算例数的情况,故予以排除。
基于对照组不同,分为4组进行比较分析:Ⅰ组,聚桂醇与平阳霉素的比较;Ⅱ组,聚桂醇与普萘洛尔的比较;Ⅲ组,聚桂醇联合平阳霉素与单独使用平阳霉素的比较;Ⅳ组,聚桂醇联合PDL与单独使用PDL的比较。
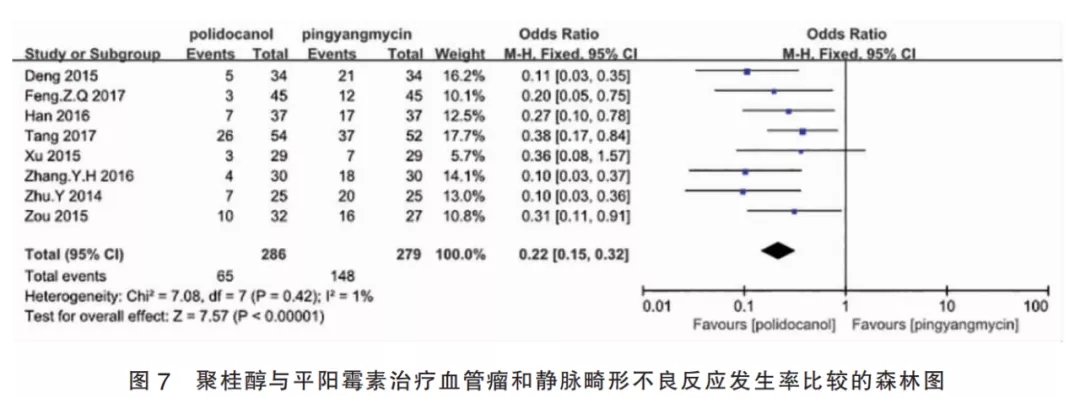
2.4.1聚桂醇与平阳霉素的比较(Ⅰ组)该组纳入8篇研究,I2=1%,故采用固定效应模型进行Meta分析。聚桂醇组共纳入患者286例,平阳霉素组共纳入患者279例,合并效应量OR=0.22,95%CI[0.15,0.32],合并效应量检验为P<0.001,差异有统计学意义,表明聚桂醇注射治疗皮肤血管瘤或静脉畸形的安全性较平阳霉素治疗组高(图7)。
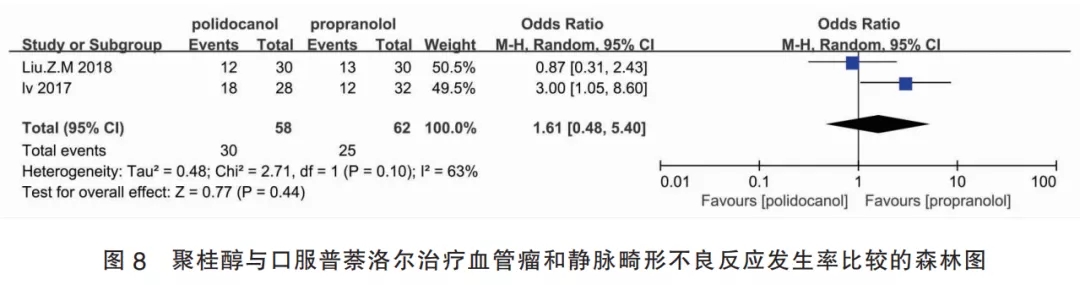
2.4.2聚桂醇与口服普萘洛尔的比较(Ⅱ组)该组纳入2篇研究,I2=63%,故采用固定效应模型进行Meta分析。聚桂醇组共纳入患者58例,普萘洛尔组共纳入患者62例,合并效应量OR=1.61,95%CI[0.48,5.40],合并效应量检验为P=0.440,差异无统计学意义,表明聚桂醇注射治疗皮肤血管瘤的安全性与口服普萘洛尔治疗组无差别(图8)。
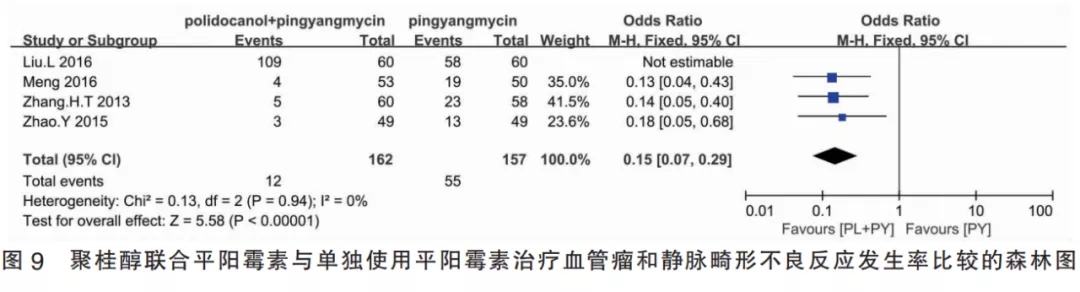
2.4.3聚桂醇联合平阳霉素与单独使用平阳霉素的比较(Ⅲ组)该组纳入4篇研究,I2=0%,故采用固定效应模型进行Meta分析。聚桂醇组共纳入患者162例,普萘洛尔组共纳入患者157例,合并效应量OR=0.15,95%CI[0.07,0.29],合并效应量检验为P<0.001,差异有统计学意义,表明聚桂醇联合平阳霉素注射治疗皮肤血管瘤或静脉畸形的安全性较单独使用平阳霉素治疗组高。刘莉等[24]的研究中仅描述各类不良反应的例数,未计算每组总不良反应数,存在重复计算的情况,故该文献予以排除,不纳入Meta分析的计算中(图9)。
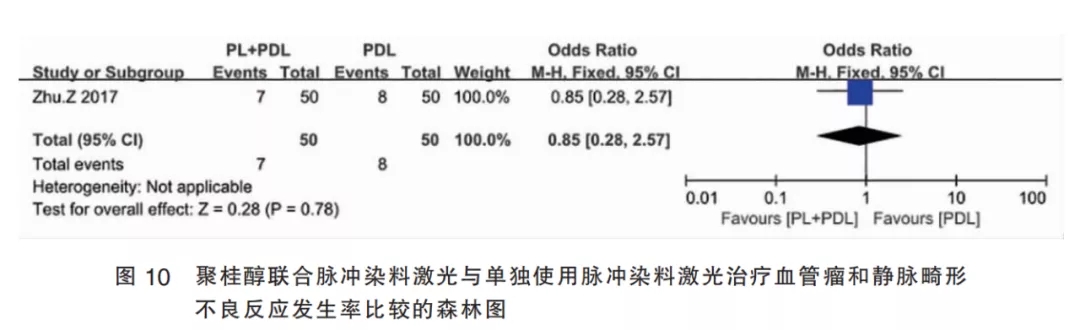
2.4.4聚桂醇联合PDL与单独使用PDL的比较(Ⅳ组)该组纳入1篇研究,该研究将患者随机分为试验组和对照组,每组50例,试验组使用聚桂醇联合PDL,对照组单独使用PDL。结果显示,聚桂醇联合PDL组与单独使用PDL组的不良反应发生率差异无统计学意义[OR=0.85,95%CI(0.28,2.57)];总效应量检验为P=0.780,由此表明,聚桂醇注射联合PDL治疗皮肤血管瘤的不良反应发生率与单独使用PDL相比无差别(图10)。
本篇Meta分析为聚桂醇注射治疗皮肤血管瘤和静脉畸形的有效性及安全性提供了验证,表明聚桂醇是一种耐受性好、疗效确切且安全性较高的药物。Meta分析的结果显示聚桂醇用于治疗皮肤血管瘤和静脉畸形时的临床治疗有效率和安全性均高于平阳霉素,且当聚桂醇联合平阳霉素、泼尼松或PDL时,比单独使用上述疗法更有效和安全。
多年来临床常使用德国研制的聚多卡醇作为硬化剂治疗皮肤血管瘤和静脉畸形,直到中国自主研制的聚桂醇在国内面世后,国内使用聚桂醇治疗皮肤血管瘤和静脉畸形的研究才逐渐增多。聚桂醇与聚多卡醇的成分一致,治疗皮肤血管瘤和静脉畸形疗效确切。本篇Meta分析中纳入的17篇文献均使用聚桂醇作为治疗用硬化剂,减少了由于产品不同导致的结果差异。结果显示,与平阳霉素相比,聚桂醇具有更高的有效率和更低的不良反应发生风险。硬化剂注射主要的不良反应包括创面破溃、感染、局部肿胀、发热、头晕、消化道反应、腹部不适及肝功能损害等,而聚桂醇导致这些不良反应的报道较少。
自从2008年Leaute-Labrere等[3]首次报道普萘洛尔作为婴儿血管瘤的治疗药物以来,普萘洛尔逐渐成为血管瘤的一线治疗药物。在本篇Meta分析中,聚桂醇注射治疗血管瘤的临床有效率和不良反应发生率与普萘洛尔相比差异均无统计学意义,分析原因可能是:①聚桂醇注射与口服普萘洛尔治疗血管瘤的疗效及安全性确实没有差异;②本篇Meta分析最终仅纳入2篇相关RCT,包括聚桂醇组58例和普萘洛尔组62例,患者总例数少。目前缺乏高质量大样本RCT来进一步验证聚桂醇局部注射与口服普萘洛尔相比的疗效和不良反应发生率差异,无法得出结论,但结合现有研究结果,聚桂醇仍是一种有效、安全及依从性较好的治疗手段。
本篇Meta分析的优势包括以下几个方面:①这是第1篇关注中国自主研制产品聚桂醇治疗血管瘤和静脉畸形的Meta分析;②这也是第1篇关注聚桂醇和口服普萘洛尔临床治疗有效率和安全性比较的Meta分析;③我们排除了所有内脏和消化道血管瘤或静脉畸形的研究,仅纳入研究皮肤血管瘤和静脉畸形,以期为皮肤科医生提供临床指导;④所有纳入研究均为RCT。本文同样存在一定的局限性,体现在:①纳入的RCT的总数量有限,每个研究的样本量相对较小;②所有纳入研究的患者均来自中国,这种地域限制同样会导致偏倚;③本篇Meta分析的RCT均被评定为低质量,目前缺乏高质量的RCT;④缺乏统一的疗效评价标准,并不是每项研究都使用国际标准评判临床有效性。
综上所述,本篇Meta分析表明,聚桂醇是一种有效、安全的用于治疗皮肤血管瘤和静脉畸形的治疗药物。聚桂醇与普萘洛尔在有效率和不良事件风险方面无显著差异,在今后的研究中需要纳入更多高质量的大规模RCT,来进一步比较聚桂醇与普萘洛尔的疗效和安全性差异。





