《安徽医科大学学报》2013年7月第7期第48卷
聚桂醇对人肝癌 HepG2 细胞增殖及迁移影响的体外研究
胡中倩,张炽敏,李嘉,李岭,王玲,沈会明,高启
摘要:
目的:体外探讨聚桂醇对人肝癌HepG2细胞的生长、迁移影响及血管内皮生长因子(VEGF)的表达调控。
方法:应用MTS比色法观察不同浓度的聚桂醇对人肝癌细胞系细胞的生长抑制作用,并观察细胞在各时间点的抑制率;平板克隆实验检测细胞克隆形成能力的变化;用细胞划痕实验观察对肝癌细胞迁移的影响;Western blot检测VEGF蛋白的表达变化。
结果:聚桂醇以剂量依赖的方式抑制HepG2细胞生长,0、20、40、60及80μg/ml聚桂醇对肝癌细胞的生长抑制率分别为0、26.78%、35.37%、51.52%和67.15%(P<0.05);聚桂醇能抑制肝癌细胞的克隆形成、迁移及VEGF蛋白表达,且抑制VEGF蛋白表达跟作用时间呈正相关。
结论:聚桂醇能抑制肝癌细胞增殖及迁移,影响VEGF蛋白表达。
关键词:
HepG2 细胞; 聚桂醇; 血管内皮生长因子; 细胞增殖; 细胞迁移
肝癌早期临床症状不典型,易浸润转移,恶性程度高,硬化剂栓塞和抗癌药物局部注射是治疗肝癌的有效途径[1-3]。聚桂醇是一种两性分子,其在液体中聚集成分子团(胶束),与细胞表面的细胞膜脂相互作用,使细胞受损[4-5]。研究[6-7]表明,聚桂醇对内皮细胞的杀伤作用可能与其对细胞膜脂的损伤作用有关。既然其对血管内皮细胞具有损伤作用,从理论上推断对于同样是上皮细胞来源的癌细胞也可能有杀伤作用。该研究以肝癌细胞株HepG2细胞为研究对象,拟分析聚桂醇对肝癌细胞增殖及迁移的影响,为聚桂醇在肝癌防治的临床研究提供实验参考。
一、 资料与方法
1.1 细胞与试剂
人肝癌细胞系HepG2由本实验室保存; 聚桂醇购自合肥森瑞化工有限公司; MTS试剂盒购自 Promega 公司; H-DMEM培养基、小牛血清及胰酶购自Gibco公司。
1.2 方法
1.2.1 细胞培养
人肝癌细胞系HepG2细胞培养于含0.5%10%小牛血清的DMEM培养液中37℃、5%CO2培养箱内常规传代培养。细胞贴壁生长24 h至70%80%单层后更换含药培养基进行实验。
1.2.2 MTS 法检测细胞毒性实验
取对数生长期的细胞经胰酶消化后轻轻吹打成单细胞悬液,调整细胞浓度为 1×105个/ml,接种于96孔培养板中,每孔100μl,培养24h待细胞贴壁生长良好时,弃原培养液,加入药物( 聚桂醇) 终浓度分别为0( 对照组) 、20、40、60 及80μg /ml的新培养液。每浓度设8个复孔,培养48h后,加入20μl/孔MTS,37℃孵育3h后,立即用318MC型全自动酶标仪(北京中西远大科技有限公司) 于 490nm处测吸光度( A) 值,实验重复3次,取8孔平均值。根据公式: 细胞抑制率( %)=(1-实验组 A 值/对照组 A 值)×100%,计算抑制率。用 Excel 软件统计分析数据并作图。
1.2.3 细胞二维克隆形成能力的检测
①常规消化收集细胞制成细胞悬液,以1000个细胞接种于60mm的平皿中;②培养至肉眼可见的单克隆出现(约2周);③弃去培养液,用PBS浸洗2遍,加入纯甲醇3ml/皿固定15min;④弃去培养液,加0.1%结晶紫3ml染色30min,流水柔和洗去,空气干燥;⑤计数:细胞数≥20个的为1个单克隆;⑥克隆形成率(%)=克隆数/接种细胞数×100%。实验重复3次。
1.2.4 细胞划痕实验检测细胞体外迁移能力
分别将对数生长期3组细胞[正常对照组、聚桂醇(20、60μg/ml)组]常规消化离心,细胞重悬,计数,调整细胞浓度为1×106个/ml,分别取1×105个细胞接种到6孔板中,细胞贴壁后用200μl移液器头沿底部呈“一”字形划痕单层培养细胞,显微镜下记录划痕区相对距离,用含5%胎牛血清(FBS)的H-DMEM培养液培养0、48h,观察并照相。实验重复3次。
1.2.5 Western blot法检测血管内皮生长因子(VEGF)蛋白水平
细胞用冰预冷的PBS洗2次,用裂解液RIPA冰上裂解30 min,4℃、12000 r/min离心30min,上清即为细胞总蛋白。细胞总蛋白用紫外分光光度法定量后,行12%SDS-PAGE分离样本,以100mA恒流转移到PVDF膜上,用含5%脱脂奶粉的TBST封闭液封闭,然后与相应的抗体孵育杂交。一抗按1∶1000稀释,HRP标记的二抗按1∶2000稀释,ECL显色系统检测目的蛋白。
1.3 统计学处理
采用SPSS 13.0统计软件进行分析,数据以±s表示,组间比较采用t检验。
二、 结果
2.1 不同聚桂醇浓度对肝癌细胞增殖的影响
MTS实验结果表明,当聚桂醇浓度<20μg/ml 时对细胞的增殖均无明显影响,当聚桂醇浓度≥20μg/ml时抑制率随其浓度增加而明显升高(20μg/ml:26.78%;40μg/ml:35.37%;60μg/ml:51.52%;80μg/ml:67.15%),与对照组比较差异有统计学意义(P<0.05)。
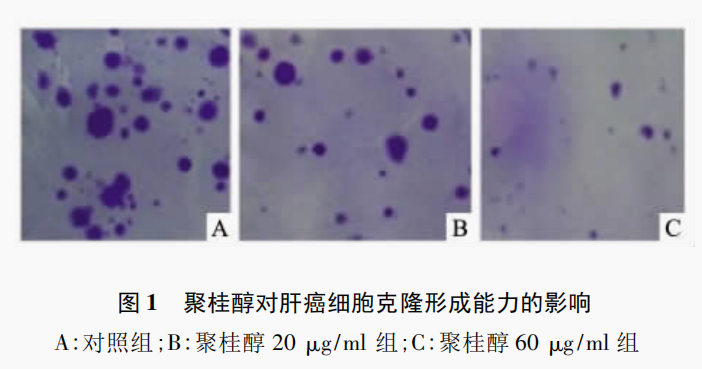
2.2 平板克隆形成实验
克隆形成实验检测,在每皿接种1 000个细胞,培养2周左右时,3组平皿中均有克隆形成,各聚桂醇组克隆形成的数量远低于对照组,见图1。聚桂醇(60、20μg/ml)组及对照组克隆形成率分别为8%、12%、52%,可知,经药物处理后,细胞较对照组增殖能力明显减弱(P<0.05)。
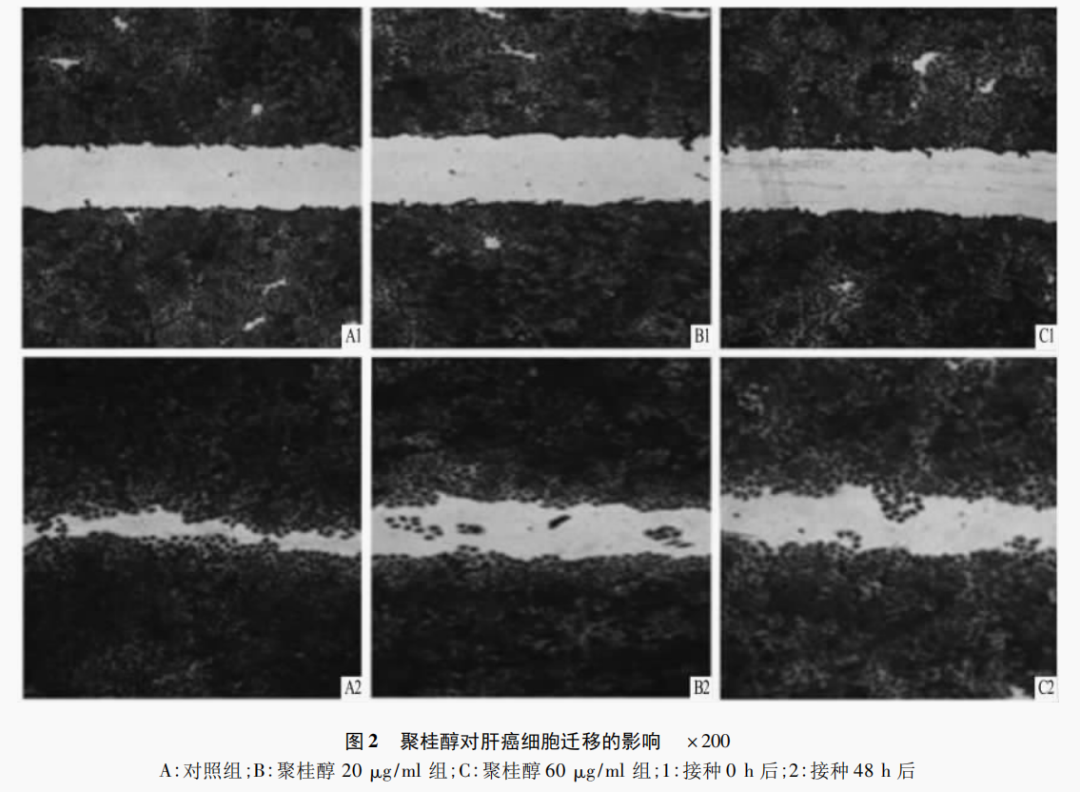
2.3 划痕实验检测聚桂醇对肝癌细胞体外迁移能力影响
体外划痕实验结果显示,聚桂醇(20、60μg/ml)组细胞的运动速度明显慢于对照组,为了避免细胞增殖对于细胞迁移的影响,该实验培养环境均用0.5%的血清浓度培养细胞,接种48h后,显微镜(10倍)下可见聚桂醇(20、60μg/ml)组划痕明显,而对照组有较多细胞已迁移至划痕中央,见图2。
2.4 聚桂醇对肝癌细胞中VEGF表达的影响
在上组实验中发现浓度为60μg/ml的聚桂醇作用于肝癌细胞48h后,可使细胞迁移明显受到影响,因此,本组实验采用终浓度为60μg/ml聚桂醇作用于肝癌细胞,检测在此相同条件下,细胞迁移受到影响的同时VEGF表达的变化情况。结果发现,在聚桂醇(60μg/ml)作用于细胞12h时VEGF表达量相对于对照组有轻度减低,当作用48h后,可使VEGF蛋白表达明显减少。经聚桂醇60μg/ml作用的处理组与对照组比较差异均有统计学意义(P<0.05),见图3。
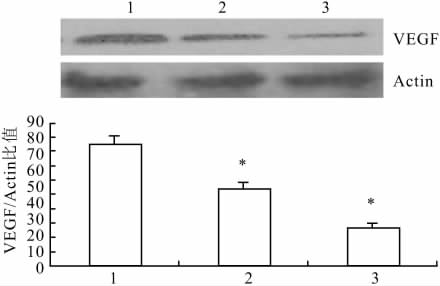
图3 聚桂醇(60μg/ml)对肝癌细胞VEGF蛋白表达的影响
1:对照组;2:聚桂醇60μg/ml处理12 h组;聚桂醇60μg/ml处理24 h组;与对照组比较:*P<0.05
三、 讨论
VEGF蛋白是从牛垂体滤泡细胞培养上清液中分离出的一种糖蛋白,可特异性促进血管内皮细胞的生长并诱导血管生成,在体内分布广泛,表达水平最高,是目前所知作用最强的促血管形成因子[8]。研究[9-11]证明实体瘤的生长以及转移灶的形成依赖于血管发生,VEGF在肿瘤的发生、形成及进展中起到关键性作用,因此抑制血管新生可作为干扰肿瘤的重要靶标。在本研究中证实,聚桂醇能够抑制肝癌细胞增殖,且呈剂量依赖关系,即在一定范围内剂量越大,细胞增殖率越低;并且可使肝癌细胞的迁移显著减慢。为进一步明确聚桂醇对肝癌细胞的生长及迁移抑制作用影响,本研究采用Western blot法检测聚桂醇作用于肝癌细胞不同时间点VEGF表达的变化,结果发现随药物作用时间延长,VEGF的表达量明显减少,表现出强烈的抗血管新生作用。这提示聚桂醇在影响细胞迁移及生长的同时,也影响了细胞内VEGF的表达水平,然而聚桂醇对于肝癌细胞的迁移影响,是否是通过抑制VEGF的表达来实现,其在此环节中起到了怎样的作用,还有待于后期研究工作不断深入开展。鉴于聚桂醇对肝癌细胞的增殖、迁移的抑制及对VEGF表达的影响,此研究为后期的实验室研究工作奠定了基础,也为聚桂醇应用于临床肝脏肿瘤预防和治疗提供了理论参考。
参考文献
[1]Gurusamy K S,Sheth H,Kumar Y,et al.Methods of vascular oc-clusion for elective liver resections[J].Cochrane Databae SystRev,2009,21(1):CD007362.
[2]Tsuruma T,Sahara H,Takeenouchi M,et al.Synthetic sulfonol-ipids deduced from sulfonoquinovosyl diacylglycerols of sea urchin reduces hepatic ischemia reperfusion injury in rats[J].Transplant Proc,2004,36(7):1965-9.
[3]Chouker A,Martignoni A,Jauch K W,et al.Beneficial effects of ischemic preconditioning in patients undergoing hepatectomy:the role of neutrophils[J].Arch Surg,2005,140(2):129-36.
[4]王言飞,刘王芝,尚明凤,等.内镜下指令联合部分脾栓塞贯治疗食管-胃底静脉曲张出现的临床研究[J].中华实用诊断与治疗杂志,2009,23(1):1100-2.
[5]王深明,胡作军,李晓曦,等.内镜筋膜下交通静脉结扎术治疗重度慢性下肢静脉功能不全51例[J].中华普通外科杂志,2003,18(9):527-9.
[6]Jia X,Mowatt G,Burr J M,et al.Systematic review of foam scle-rotherapy for varicose veins[J].Br J Surg,2007,94(8):925-36.
[7]Barrett J M,Allen B,Ockelford A,et al.Microfoam ultrasound-guided sclerotherapy of varicose in 100 legs[J].Dermatol Surg,2004,30(1):6-12.
[8]Zielke A,Middeke M,Hoffmann S,et al.VEGF-mediated angio-genesis of human pheochromocytomas is associatedo to malignancy and inhibited by anti-VEGF antibodies in experimental tumors[J].Surgery,2002,132(6):1056-63.
[9]路顺,唐先发,权晟,等.VEGF基因多态性与汉族人银屑病易感性相关性研究[J].安徽医科大学学报,2009,44(3):318-21.
[10]张鹏飞,吴继锋,张红,等.胃癌中HIF-1α?VEGF及Glut1的表达[J].安徽医科大学学报,2010,45(1):86-9.
[11]Johnstone S,LoganRM.The role of vascular endothelial growth factor(VEGF)in oral dysplasia and oral squamous cell carcinoma[J].Oral Oncol,2006,42(4):337-42.


