发布时间:2021-04-12 17:28:36 来源: 浏览次数:827
《上海口腔医学》2021年8月第30卷第4期
双极电凝联合1%聚桂醇泡沫硬化剂治疗16例舌微囊型淋巴管畸形疗效观察
李嘉朋,张国润,陈巨峰,李金,刘士维,贺先明,冼淡
摘要:
目的:评价双极电凝联合 1%聚桂醇泡沫硬化剂治疗舌微囊型淋巴管畸形的临床疗效及安全性。
方法:回顾分析2017年4月—2020年4月佛山市第一人民医院口腔科收治的16例舌微囊型淋巴管畸形患者的临床资料,男7例,女9例,年龄15个月~21岁,平均(8.32±1.21)岁,对治疗效果和并发症进行分析。
结果:16例患者全部随访6~12个月。疗效评价为Ⅳ级11例(68.75%),Ⅲ级3例(18.75%),Ⅱ级2例(12.5%),Ⅰ级0例,有效率87.5%。1例出现舌黏膜、舌肌坏死。
结论:双极电凝联合1%聚桂醇泡沫硬化剂治疗舌微囊型淋巴管畸形是一种微创、安全、有效的治疗方法。
关键词:
舌;微囊型淋巴管畸形;双极电凝;聚桂醇泡沫硬化剂
淋巴管畸形(lymphatic malformation,LM)是常见的先天性低流量脉管畸形,发病率为1/4 000~1/2 000,约50%的患者出生时即发现罹患此病[1]。LM可发生在具有淋巴管网的身体任何部位,约75%发生在头颈部。舌是最常受累的器官,舌体LM绝大部分属于微囊型[2]。LM的治疗方法包括手术、冷冻、激光、硬化注射、栓塞治疗、射频消融及口服雷帕霉素等[3-6]。单纯手术切除很难达到根治目的,反而会引起舌缺损、出血、复发等不良后果,目前,更多学者倾向于以微创方法进行治疗。近年来我们应用双极电凝联合1%聚桂醇泡沫硬化剂治疗舌微囊型LM,取得了较好的临床效果,现总结报道如下。
一、资料与方法
1.1 临床资料
回顾分析2017年4月—2020年4月佛山市第一人民医院口腔科收治的16例舌微囊型LM患者的临床资料,男7例,女9例,年龄15个月~21岁,平均年龄(8.32±1.21)岁。所有患者均采用双极电凝联合1%聚桂醇泡沫硬化剂注射治疗。纳入标准:①符合“血管瘤和脉管畸形诊断和治疗指南(2019版)”的诊断标准,确诊为舌微囊型LM,表现为舌体实性病变,舌黏膜表面有成簇、充满液体的小泡突起[1];②未合并其他脉管性疾病;③患儿肝、肾功能正常,未合并败血症、严重凝血功能障碍或心肺功能不全;④无聚桂醇过敏史。排除标准:①病史资料不完整;②伴发严重感染。
本研究通过佛山市第一人民医院医学伦理委员会审批[批准号:伦审研(2020)第52号],所有患儿监护人均被告知治疗可能存在的风险及相关并发症,并签署手术知情同意书。
1.2 治疗方法
泡沫硬化剂制备:采用Tessari法[7]制作泡沫,1%聚桂醇注射液(10 mL∶100 mg,陕西天宇制药有限公司生产,国药准字H20080445,批号20120901)与空气体积比为1∶4。双极电凝器设备:美国威利公司Force FX-8C高频电刀,双极电凝镊JBW/D-D,双极电凝输出功率30~40 W。
全麻成功后,取仰卧位,常规消毒术区、铺巾,开口器开口,牵引出舌体,暴露LM病灶。采用7号头皮针穿刺舌体病灶,向黏膜下病灶内多点进针(视病灶范围,可同时穿刺3~4针),采用高压力、浸润性注射方法,以注药后病灶表面变苍白或见药液从舌黏膜小泡渗出为度。单次药物用量视病灶范围而定,一般4~6 mL。注射后,以双极电凝对舌黏膜簇状突起的小泡进行电凝烧灼(病灶边缘个别零散的小泡不需注射硬化剂,直接进行电凝),输出功率30~40 W,至小泡发白、萎缩为度;如渗血明显,可反复电凝止血。最后拔出穿刺针,压迫止血。间隔3~4周复诊,如舌体病灶仍有残留,则重复上述治疗。
治疗的终点:①临床症状消失,病灶残留<10%;②联合治疗3次或以上,症状无缓解甚至加重;③患者放弃治疗。
1.3 疗效评价
①疗效标准:治愈:症状消失,痔核消失或完全回缩;好转:症状改善,痔核缩小;未愈:症状及体征均无变化。总有效率=治愈率+好转率。②观察两组患者治疗后3个月的再出血、肛门瘙痒发生率以及复发率。③统计两组患者的痊愈时间、术后2 h疼痛情况、脱出改善评分与生活满意度评分。其中术后疼痛采取视觉模拟评分表(VAS),分值0~10分,得分越高表明疼痛越严重。脱出改善评分的分值为1~3分,其中1分表示轻度改善,2分表示中度改善,3分表示明显改善。生活满意度评分采取自制的满意度问卷进行调查,问卷总分为100分,分为非常满意(90~100分)、满意(70~89分)与不满意(70分以下)三个等级。
1.4 不良反应
对术后全身及局部不良反应进行记录,包括舌黏膜糜烂、溃疡、表皮脱落、舌体组织坏死、神经损伤、肺栓塞等。由于几乎所有患者硬化治疗后均出现不同程度的肿胀、疼痛,一般7~10 d后消退,且这种肿痛是硬化剂治疗后的常规反应,所以不归入不良反应。
二、结果
2.1 基本资料
16例舌微囊型LM,病灶位于单侧舌侧缘2例、舌前份4例、舌中份7例,均有不同程度肿胀,对讲话、吞咽有一定影响,其中3例偶发舌黏膜出血;位于舌根3例,有不同程度的阻塞性睡眠呼吸暂停综合征症状。舌LM呈局限性或弥漫性分布,无巨舌症病例。
2.2 治疗效果
随访6~12个月,平均9.8个月,16例患者均成功进行治疗。治疗次数1~4次,平均(2.8±0.9)次。1%聚桂醇原液单次用量10.2~28.8 mg,平均(17.3±2.3)mg。16例中,疗效Ⅳ级11例(68.75%),Ⅲ级3例(18.75%),Ⅱ级2例(12.5%),Ⅰ级0例(0%),有效率为87.5%。3例患者在治疗结束后仍有部分LM残留,但为了保留舌体组织,使之不会因为过度萎缩而影响功能及外观,所以不再进一步治疗,随访过程中未见LM复发。
2.3 不良反应
16例患者治疗后均发生舌体肿胀,经对症治疗后,一般5~7 d后消退,无一例发生因肿胀引起的呼吸道梗阻或进行气管切开。2例患者术中在舌体穿4号缝线以便紧急时牵出舌体,预防窒息,术后第3天拆线。15例出现舌黏膜糜烂、溃疡、表皮脱落,经对症治疗,局部清洗上药,漱口水含漱,5~9 d后舌组织创口愈合。1例舌黏膜、舌肌坏死,经清创、剪除舌体坏死组织、口服抗生素,9 d后痊愈,未出现舌体变形或舌功能障碍。所有病例无术后发热,未发生舌神经、舌下神经损伤,无发音、吞咽困难等不良反应,未发生肺栓塞等严重并发症。
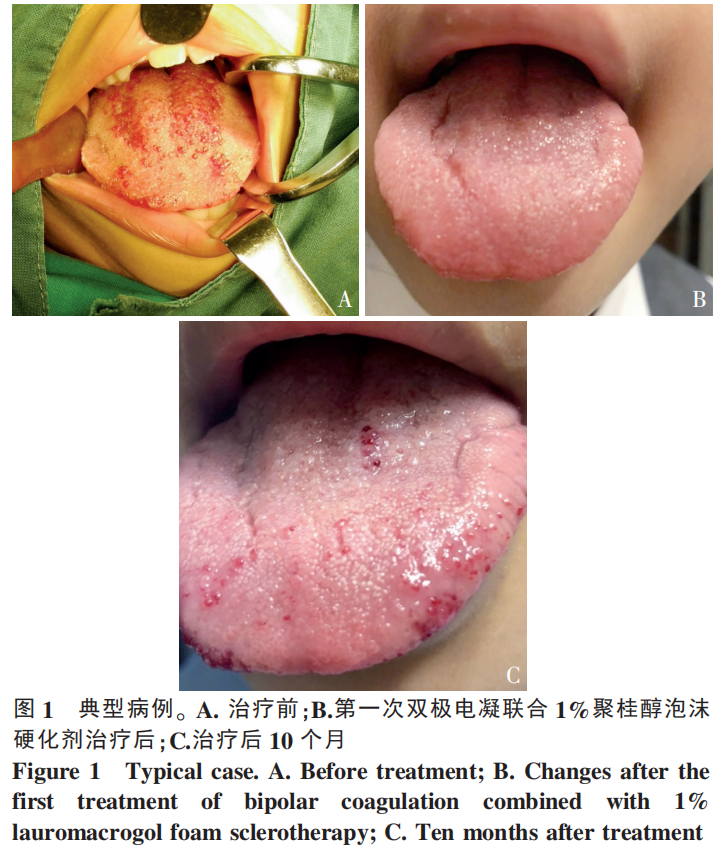
2.4 典型病例
女,8岁,舌体增大,舌黏膜病变呈红白相间粟粒状小泡状突起,弥漫分布,累及大部分舌体,侵犯舌黏膜、舌肌,偶有出血、口臭。临床诊断为舌微囊型LM。全麻下穿刺舌体病灶,注射1%聚桂醇泡沫硬化剂,舌黏膜小泡状突起以双极电凝烧灼,术后给予消肿止痛药物、口腔清洁护理等对症治疗。共治疗3次,随访10个月,病灶缩小85%,舌体光滑、色泽正常、外形接近正常,临床治愈,无并发症发生。
三、讨论
LM根据淋巴管囊腔的大小,可分为巨囊型、微囊型和混合型。巨囊型LM由1个或多个体积≥2 cm3的囊腔构成,而微囊型LM则由多个体积<2 cm3的囊腔构成,两者兼有则称为混合型LM[9]。1854年,Virchow第一次准确地描述了发生于舌部的淋巴管瘤(畸形)。累及舌的LM并不少见,且几乎都是微囊型。李克雷等[10]将微囊型淋巴管畸形分为局限型、弥漫型和巨舌症型,临床上以局限型、弥漫型多见。本组病例中,局限型5例,弥漫型11例。舌微囊型LM不难诊断,舌体病灶多为实质性,舌背、舌腹黏膜可见半透明,红白相间的小泡状突起。局限型一般症状不明显,生长缓慢,常伴随上呼吸道感染而反复发作;弥漫型或巨舌症型可导致发音不清、吞咽和咀嚼困难,部分患者可因继发感染、咬伤或出血,导致病灶增大、口臭等。随着炎症消退,病灶可能有所缩小,但不会自然消退。
LM的治疗方法较多,手术切除曾是主要的治疗手段,但由于病灶广泛、边界不清,并且累及不同深度的舌体组织,单纯手术切除很难彻底“清除”病灶,还会导致出血、舌体组织缺损、舌功能受损、复发等不良后果[11],目前已不主张毫无选择地对任何类型的LM都进行手术切除[1]。随着硬化治疗逐渐成为治疗脉管畸形的主要手段,应用硬化剂(如平阳霉素、博莱霉素、无水乙醇、泡沫硬化剂等)局部注射已成为大多数舌LM的首选治疗方案。此外,激光、口服雷帕霉素等方法在临床上也有一定程度的应用[1]。
平阳霉素、博莱霉素是治疗舌LM最常用的硬化剂,但两者均为抗肿瘤药物,而LM多发生于低龄患者,使用抗肿瘤药物的毒副作用和远期不良反应尚未得到系统研究,且其导致肺纤维化的风险也不容忽视。我国生产的聚桂醇主要成分为聚氧乙烯月桂醇醚,与德国的聚多卡醇注射液是同一种化合物,均为表面活性剂类硬化剂。在我国,1%聚桂醇注射液是常用的泡沫硬化剂。鉴于其安全有效、副作用少等优点,近年来逐渐广泛用于口腔颌面部血管瘤和脉管畸形的治疗[12]。
聚桂醇具有固定的亲水端和疏水端,在溶液表面能够定向排列,可干扰细胞膜上的表面活性分子,破坏细胞膜结构并使表面张力显著降低;通过裂解血管内膜细胞导致其死亡,进而发生血管纤维化及血管闭塞[13]。聚桂醇制备成泡沫硬化剂注射到病灶内,在管腔内均匀分布,暂时阻断血流,保持相对确定的药物浓度;同时增加与管腔的接触面积,延长作用时间,通过对内皮细胞的破坏作用而达到硬化治疗的效果。近年来,越来越多的文献肯定了聚桂醇治疗LM的安全性和有效性[14]。
舌微囊型LM病损为边界不清、弥散分布的成簇小泡状突起,组织学表现为异常扩张的囊状管腔,充满淋巴液,病灶之间有微细的管道连通[15]。鉴于此特点,本研究采用舌黏膜下多点、高压力注射方法,使聚桂醇泡沫硬化剂尽可能扩散到LM异常的管腔和各个扩张的小泡中,与内皮细胞充分接触,达到理想的治疗效果。操作要点:①确保穿刺针头进入舌黏膜下之后再推注硬化剂,如果注射深度不足,容易造成药液外渗,降低药效;②使用高压力、浸润性注射,可以先向舌组织深部穿刺,一直保持较高的压力,逐渐退出穿刺针头。当针头到达LM腔隙时,药液很容易渗入病变内,舌黏膜表面的小泡被泡沫硬化剂充满,迅速发白;③适宜在LM小泡较密集的部位行多点注射,使泡沫硬化剂尽可能充满病灶。
双极电凝将2个电极分别接在镊子的2个尖端,通过工作尖向机体组织提供高频电能,使组织血管胶原蛋白和纤维蛋白等溶解变性,达到凝血及永久性闭合管腔的目的[16]。其优点是作为泡沫硬化剂的补充手段,对表浅的零散的微囊型LM小泡起到准确快速的凝固作用,减少泡沫硬化剂的用量。由于高频电能产生的热效应局限于2个工作尖之间,所以热扩散对邻近的正常组织损伤较轻,不会造成舌体大面积烧灼伤或坏死。操作时,工作尖的距离应保持在5 mm以内,分区、多次、点触式进行电凝。
几乎所有LM病例在硬化治疗后都会出现不同程度的组织水肿,而发生在舌组织的肿胀更不容忽视。位于舌侧缘、舌前份、舌中份的肿胀主要影响讲话及吞咽,一般经过消肿治疗可缓解;位于舌根部的LM则需要警惕硬化后肿胀引起呼吸道阻塞,尤其是儿童患者发生窒息的风险。由于大部分LM患者在婴幼儿期便出现病变,舌体长期肿大,已出现功能代偿,可耐受硬化治疗后的组织水肿,气道阻塞的风险较低。但对于范围较大并侵犯上呼吸道的LM,经术前评估,认为硬化治疗后呼吸梗阻、窒息的风险较高者,应先行气管切开,再进行硬化治疗。本组3例舌根微囊型LM术前均无严重阻塞气道,硬化后仍可耐受局部水肿,故未行气管切开术。气管切开患者由于需要连续行多次硬化治疗,每次间隔约3~4周,建议在硬化治疗期间保留气管套管,待舌LM明显缩小,硬化治疗后气道阻塞风险明显降低时再考虑拔除气管套管。此处理原则与舌静脉畸形相同,均可有效保持气道通畅,防止窒息发生[17-18]。
本组15/16例患者在高频电凝后出现不同程度的舌黏膜糜烂、溃疡、表皮脱落、甚至口腔异味。由于舌体血供丰富,抗感染能力强,只要注意口腔护理,1周左右均可治愈。1例出现局部舌黏膜、舌肌坏死,考虑可能的原因有:①单次注射聚桂醇泡沫硬化剂量太大、压力过高,使硬化剂进入舌体的分支动脉,造成动脉栓塞;②电凝输出功率过高、范围过大、时间过长,造成局部组织烧灼伤及坏死。所以,注射泡沫硬化剂时应坚持多点、缓慢推注。使用双极电凝镊时,应控制好操作时长及电凝深度,以LM小泡发白、凝固、萎缩为度。
综上所述,双极电凝联合1%聚桂醇泡沫硬化剂治疗舌微囊型LM操作简便、创伤小,全身及局部不良反应较少,是一种微创、安全、有效的治疗方法。值得强调的是,LM的治疗要权衡治疗效果与不良反应的利弊,并非一定要达到“彻底”治愈,必须充分考虑修复或保留患者的功能及外观美学的重要性[19]。
参考文献




