《医师在线》第15卷第10期
1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔治疗混合型婴幼儿血管瘤的疗效观察
周洲,熊健,龙启梅,李娅娅,周卓,饶修亮,刘润捷
(上海交通大学医学院附属上海儿童医学中心贵州医院儿童普外 / 胸外 / 血管瘤外科,贵州贵阳 550081)
摘要:
目的:探讨 1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔治疗混合型婴幼儿血管瘤的临床治疗效果。
方法:选取我院 2023 年 1月至 2025 年 1 月收治的 103 例混合型婴幼儿血管瘤患儿为研究对象,采用随机分组法分为观察组(53 例)和对照组(50 例)。对照组给予普萘洛尔治疗,观察组给予普萘洛尔联合 1% 聚桂醇泡沫硬化剂局部注射治疗。记录并比较两组的临床治疗效果和不良反应发生情况。检测并比较两组患儿治疗前、后的血清血管内皮生长因子 -A(VEGF-A)、表皮生长因子样结构域 7(EGFL7)、缺氧诱导因子 -1α(HIF-1α)、基质金属蛋白酶 -9(MMP-9)水平。
结果:观察组的临床总有效率为 94.34%,显著高于对照组的 80.00%(P < 0.05)。两组不良反应总发生率比较,差异无统计学意义(P>0.05)。治疗后,观察组血清VEGF-A[(203.17±39.28) pg/mL vs (278.65±43.68) pg/mL]、EGFL7 [(6.89±1.75) pg/mL vs. (15.29±3.26) pg/mL]、HIF-1α[(0.15±0.02) mg/L vs. (0.18±0.03)mg/L]、MMP-9 [(762.96±156.79) pg/mL vs. (1 057.59±166.08) pg/mL]水平均较对照组低(P< 0.05)。
结论:1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔对混合型婴幼儿血管瘤治疗效果显著,可降低患儿血清 VEGF-A、EGFL7、HIF-1α、MMP-9 水平,且安全性良好。
关键词:聚桂醇;普萘洛尔;婴幼儿血管瘤;局部注射
婴幼儿血管瘤是婴儿中最常见的良性血管肿瘤,其中混合型婴幼儿血管瘤因同时存在表浅型和深部病变,可增加治疗的难度 [1]。目前,婴幼儿血管瘤在临床常用的治疗方法包括口服类固醇、干扰素、β 受体阻滞剂及激光治疗、手术切除等 [2]其中,普萘洛尔可通过促进血管收缩、抑制细胞增生与血管生。成、诱导细胞凋亡及通过肾素 - 血管紧张素系统作用于血管瘤,进而抑制血管瘤增殖 [3]。但临床实践表明,仅采用口服普萘洛尔方案治疗血管瘤时,仍有部分患者的疗效并不理想。因此,探索疗效更显著的联合治疗方案具有重要的临床意义。硬化疗法通过对病灶注射相应硬化剂后,引发无菌性炎症,该炎症反应进一步促进结缔组织的增生和纤维化,最终使瘤体进行性萎缩或消退 [4]。1% 聚桂醇泡沫硬化剂作为一种新型硬化剂,在泡沫状态下,具有与血管壁接触面积大、作用时间长、安全性高等优点,在成人血管畸形及婴幼儿血管瘤的治疗中已展现出良好的应用前景。因此,本研究采用 1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔口服的治疗方案,旨在评估该联合方案治疗混合型婴幼儿血管瘤的临床疗效及安全性。
一、 资料与方法
1.1 一般资料
选取我院 2023 年 1 月至 2025 年 1 月收治的 103 例混合型婴幼儿血管瘤患儿为研究对象,采用随机分组法分为观察组(53 例)和对照组(50 例)。纳入标准:①临床确诊为血管瘤;②属于混合型血管瘤;③无注射药物过敏史。排除标准:①伴有严重肝、肾功能不全;②存在造血系统功能障碍;③伴有凝血功能异常。其中,观察组男 22 例,女 31 例,年龄 9 ~ 21个月,平均(1.23±0.22)岁;对照组男 21 例,女 29 例,年龄 8 ~ 26 个月;平均(1.30±0.32)岁。两组患儿的一般资料比较,差异无统计学意义(P > 0.05),具有可比性。
1.2 方法
所有患儿治疗前均完成血常规、尿常规、肝肾功能、凝血功能、心电图及胸部 X 片检查,排除治疗禁忌证。治疗期间暂停疫苗接种,若患儿出现发热或腹泻则顺延治疗。
对照组接受盐酸普萘洛尔片(广东和博制药有限公司,国药准字 H44023740,规格:10 mg)治疗,起始剂量按月龄调整:患儿≤ 3 个月予以 1.0 mg/kg,患儿> 3 个月予以1.5 mg/kg,每天 2 次,餐后口服;初始治疗需住院观察 3 ~ 5 d,无不良反应后出院,由家属按医嘱持续给药 4 个月。
观察组在对照组治疗方案的基础上,加用 1% 聚桂醇泡沫硬化剂进行局部注射治疗。1% 聚桂醇泡沫硬化剂注射流程:取用两支 5 mL 注射器及一个三通阀,一支抽取 1% 聚桂醇注射液(陕西天宇制药有限公司,国药准字 H20080330)1 mL,另一支抽取空气 4 mL,按 1 ∶ 4 比例通过三通阀快速往复推注 20 次制成泡沫。消毒瘤体表面皮肤后,于瘤体边缘外约 0.5 cm 处选 2 ~ 3 点进针至基底部,回抽见血后缓慢注入泡沫硬化剂(注射体积按 1 mL/cm2 估算,总注射量根据瘤体特性及患儿年龄综合确定),直至瘤体明显肿胀、颜色变白为止,术后注射区加压 5 ~ 10 min。间隔 1 周后行第 2 次注射,连续治疗 4 个月后进行复查,评估瘤体消退程度并记录不良反应。
1.3 观察指标
1.3.1 临床疗效
比较治疗前及治疗后的血管瘤面积、色泽变化及超声检查结果进行临床疗效评估。疗效判定参照 Achauer 等 [5] 提出的标准,分为以下四级:Ⅰ级:瘤体缩小< 25%;Ⅱ级:25% ≤瘤体缩小≤ 50%;Ⅲ级:50% <瘤体缩小< 75%,且色泽明显变淡,功能基本恢复,但残留病灶;Ⅳ级:瘤体缩小≥ 75%或完全消退,肤色基本恢复正常,病灶接近消失。总有效率=(Ⅲ级+Ⅳ级)例数 / 总例数 ×100%。
1.3.2 血清因子
患儿分别于治疗前及治疗 4 个月后,空腹采集外周静脉血 2 mL。经 2 000 r/min 离心 10 min 后,提取血清备检。采用酶联免疫吸附法(ELISA)检测血清中血管内皮生长因子 -A(VEGF-A)、表皮生长因子样结构域 7(EGFL7)、缺氧诱导因子 -1α(HIF-1α)、基质金属蛋白酶 -9(MMP-9)的水平。
1.3.3 不良反应
记录两组患儿在治疗期间出现的不良反应,包括但不限于:发热、心动过缓、低血压、恶心、呕吐、皮疹、呼吸困难、局部组织坏死及溃疡等。
1.4 统计学方法
所有数据均通过 SPSS 21.0 软件进行分析处理。符合正态分布的计量资料以均数 ± 标准差( -x±s)表示,组间比较采用独立样本t 检验,组内治疗前后比较采用配对t 检验。计数资料以[例(%)]表示,采用卡方检验。以P < 0.05 表示差异具有统计学意义。
二、 结果
2.1 两组临床疗效比较
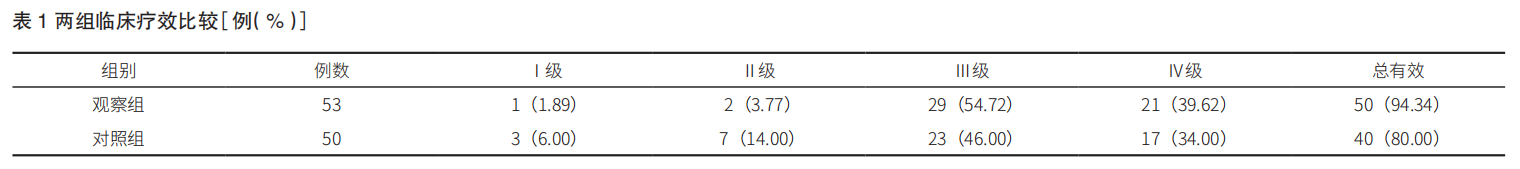
观察组的临床总有效率为94.34%,显著高于对照组的80.00%(χ2=4.797,P=0.029 < 0.05)。详见表1。
2.2 两组治疗前后血清因子水平比较
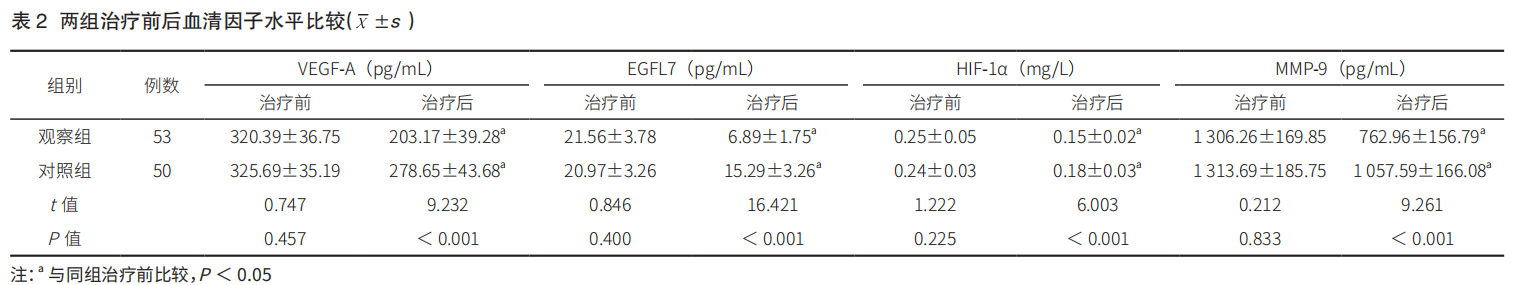
治疗后, 观察组与对照组的血清VEGF-A、EGFL7、HIF-1α、MMP-9 水平均较治疗前降低,且观察组的下降幅度均显著大于对照组(P < 0.05)。详见表 2。
2.3 两组不良反应发生情况比较
观察组出现发热及溃疡各1例,不良反应发生率为 3.77%,对照组出现低血压1例,不良反应发生率为 2.00%,且上述所有不良反应经对症治疗后均消退。两组不良反应总发生率比较,差异无统计学意义(χ2=0.003,P=0.959)。
2.4 典型病例
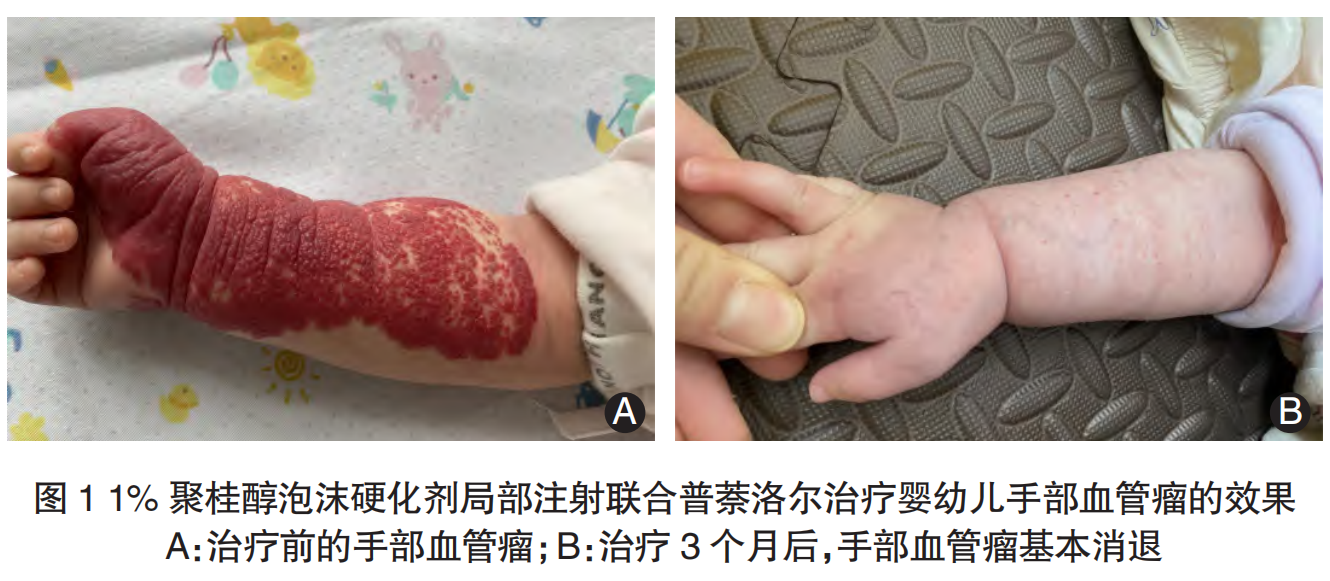
使用 1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔治疗混合型婴幼儿手部血管瘤的效果,见图1。
三、 讨论
婴幼儿血管瘤是一种由血管内皮细胞异常增殖引起的良性血管肿瘤,好发于婴幼儿的皮肤及皮下组织,其发病部位以头颈部最为常见,其次为躯干与四肢 [6]。虽然大多数婴幼儿血管瘤无需治疗,可自行消退,但部分患儿仍可出现并发症,因此需要及时治疗 [7]。
本研究结果表明,1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔治疗混合型婴幼儿血管瘤具有显著优势,与既往研究 [8]结论一致。混合型婴幼儿血管瘤的病理特征为表浅与深部病灶并存,而单一治疗手段往往难以兼顾两者。
普萘洛尔是一种非选择性肾上腺素能 β 受体阻滞剂,是婴儿血管瘤的一线治疗药物,其作用机制主要是通过抑制血管内皮细胞增殖、诱导血管收缩及促进细胞凋亡发挥作用 [9]。此外,普萘洛尔能够对人脐静脉内皮细胞的增殖、迁移及成管潜能产生抑制效果,同时可诱导该细胞的凋亡,并下调性别决定区 Y框 18(SOX18)、基质金属蛋白酶 -7(MMP-7)及 VEGF-A的表达水平 [10]。然而,单独使用普萘洛尔对混合型血管瘤的治疗效果有限。
聚桂醇是我国自主研发的新型硬化剂,既可直接以原液形式注射,也能与空气按特定比例混合制成泡沫后使用。当聚桂醇注射液被注射到曲张静脉周边时,能够促使静脉周围组织发生纤维化,并可对血管内皮造成损伤、加速血栓生成,进而引发管腔变窄,最终使血管闭塞,从而达到硬化治疗的效果[11]。1%聚桂醇泡沫硬化剂通过局部注射后,泡沫状结构可扩大与血管壁的接触面积,延长作用时间,弥补了普萘洛尔对深部病灶作用不足的缺陷。钱莹莹等 [12] 研究表明,采用 1% 聚桂醇泡沫硬化剂治疗婴幼儿血管瘤,不仅安全有效,而且还具有治疗周期短的优势。本研究结果亦表明,在安全性方面,1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔治疗混合型婴幼儿血管瘤,并未显著增加不良反应发生风险。聚桂醇作为新型硬化剂,其泡沫剂型可减少药物用量,降低局部组织坏死及感染等并发症的发生;普萘洛尔的不良反应多与剂量相关,本研究通过严格控制用药剂量及监测心率、血压等指标,有效保障了治疗的安全性。因此,1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔治疗混合型婴幼儿血管瘤,可发挥协同作用,提高治疗效果。
目前,临床上对于血管瘤的发病机制尚未完全明确,临床认为血管瘤的发生可能与缺氧等因素有关。血管内皮生长因子(VEGF)作为肿瘤血管内皮细胞增殖的关键因子,不仅可以推动血管内皮细胞的增殖进程并促进新生血管生成,还能为肿瘤细胞迁移搭建基质基础,而 VEGF-A 是该家族中的成员之一 [13]。李立佳等[14] 研究表明,柠檬苦素类似物Toonaciliatin A 能够以 T 淋巴瘤侵袭转移诱导基因 1(Tiam1基因)为作用靶点,通过抑制血管内皮生长因子及其受体 2(VEGF/VEGFR2)信号通路来减缓血管瘤内皮细胞的增殖进程,并促使该细胞发生凋亡。此外,Zhang 等 [15] 研究结果显示,HIF-1α 通过调控 VEGF/VEGFR2 信号通路影响血管瘤内皮细胞(HemEC)的细胞周期,进而促进 HemEC 增殖并抑制凋亡。Hu 等 [16] 研究表明,微小 RNA-203a-3p(miR-203a-3p)可通过灭活 VEGF-A 和磷脂酰肌醇 3 激酶 / 蛋白激酶 B(PI3K/AKT)信号通路,从而抑制血管瘤内皮细胞的增殖和侵袭,并促进凋亡。刘东波等 [17] 研究提示,HIF-1α 能够诱导下游靶基因(如葡萄糖转运蛋白 -1、VEGF-A 及胰岛素样生长因子 -2 等)的表达增加,进而引发内皮细胞的过度增殖。
EGFL7 在胚胎发育进程中主要发挥介导作用,可促使内皮细胞发生运动,并迁移至特定位置,进而形成血管管腔。若EGFL7 表达缺失,则会致使胚胎在血管管腔的形成过程出现障碍。EGFL7 被血管内皮细胞分泌后,会在分泌细胞附近区域停留,这一现象提示其可能与细胞外基质存在关联,并参与介导细胞间的相互作用 [18]。基质金属蛋白酶(MMPs)不仅能通过降解细胞外基质蛋白,来促进血管内皮细胞迁移和管腔结构形成,而且还能促进 VEGF 等血管生成因子的释放 [19]。其中,MMP-9 在调控血管内皮细胞迁移及血管新生进程中扮演着至关重要的角色,抑制其活性可显著削弱人微血管内皮细胞的侵袭能力,同时还可使血管形成过程受到明显抑制 [20]。
本研究结果显示,治疗后,观察组患儿的血清 VEGF-A、EGFL7、HIF-1α 及 MMP-9 水平均显著低于对照组,提示 1%聚桂醇泡沫硬化剂局部注射联合普萘洛尔治疗混合型婴幼儿血管瘤,可通过降低上述血清因子水平进而发挥治疗作用。但是,在使用 1% 聚桂醇泡沫硬化剂局部注射时,需注意以下事项:①注射前需借助超声或触诊精准定位病灶范围、深度及毗邻血管、神经的位置,并标记靶血管走行,避免将药物误注至肌层或重要神经旁;②推荐采用 Tessari 法制备泡沫,聚桂醇与空气按 1 ∶ 4 ~ 1 ∶ 5 的比例快速往复推注,形成质地均匀、细腻的泡沫,并需在制备后 10 min 内使用以防止泡沫破裂。③注射时宜选用 25 ~ 27 G 细针头,浅表病灶以 15 ~ 30 °角进针,深层病灶可调整至 45 °角,回抽无血后以 0.1 ~ 0.3 mL/min的速度缓慢推注,遵循“多点少量”原则,每点注射量不超过0.5 mL,单次总剂量不超过 4 mL,推注过程中保持匀速低压,观察到病灶表面变白或轻微隆起即可停止注射。④操作过程中应动态评估,若患儿出现剧烈疼痛,则立即停止注射。 注射完成后,以无菌棉球按压穿刺部位 5 ~ 10 min,随后使用弹性绷带加压包扎 24 ~ 48 h。⑤术后需密切观察局部反应,若出现红肿、疼痛加剧等症状,应及时冷敷,并给予抗组胺药物处理;若发现皮肤苍白、温度降低,应及时松解绷带并热敷处理,且要避开皮肤破溃、感染区域及重要器官附近。⑥对聚桂醇过敏、严重肝肾功能不全或凝血功能障碍者禁用该疗法,儿童及老年患者需减半剂量并分次注射,以提升治疗安全性与疗效,减少不良反应的发生。
综上所述,1% 聚桂醇泡沫硬化剂局部注射联合普萘洛尔对混合型婴幼儿血管瘤治疗效果显著,可有效降低患儿血清VEGF-A、EGFL7、HIF-1α、MMP-9 水平,且安全性良好。但本研究仍存在一定的局限性:首先,本研究为单中心研究;其次,纳入的样本量相对较小。因此,本研究结果可能不具有普适性,未来仍需通过多中心、大样本量的研究进一步验证上述结论。








