《组织工程与重建外科杂志》2019年10月第15卷第5期
血管瘤和脉管畸形的诊断及治疗指南(2019版)
中华医学会整形外科分会血管瘤和脉管畸形学组
文献编号:
doi:10.3969/j.issn.1673-0364.2019.05.001
第一部分 血管瘤和脉管畸形的分类
1982 年, John B.Mulliken 首次提出基于血管内皮细胞生物学特性的分类法, 将传统的“血管瘤”(Vascular anomalies)重新分为血管瘤(Hemangioma)和脉管畸形(Vascular malformation)。这一分类观点被广泛认同,ISSVA 于2018 年对该分类系统再次修订。本文就此次修订的主要变动进行介绍,并附上最新的分类系统。
婴幼儿血管瘤的分型包括单发型、多发型、节段型、中间型。其临床分类可分为浅表性、深在性、混合性(即浅表性+深在性)、网状性/顿挫性/微增生性和其他。
婴幼儿血管瘤还可合并其他病变, 如PHACE综合征(表现为:后颅凹畸形、血管瘤、动脉病变、心血管病变、眼病变、胸骨裂和/或脐上裂缝等),LUMAR(SACRAL/ PELVIS)综合征(表现为:下半躯体血管瘤,泌尿生殖系统病变,溃疡,脊髓病变,骨畸形,肛门直肠畸形,动脉病变,肾脏病变等)。










暂未归类的脉管性病变* 包括:肌间血管瘤**、角化性血管瘤、窦状血管瘤、肢端动静脉“瘤”、多发性淋巴管内皮瘤病合并血小板减少/皮肤内脏血管瘤病合并血小板减少(MLT/CAT)、PTEN(型)软组织错构瘤/软组织"血管瘤病"(PHOST)和纤维脂肪性血管性病变(FAVA)等。其中,某些疾病合并血小板减少和/或消耗性凝血功能障碍;肌间血管瘤不同于普通IH。
虽然, 在脉管畸形领域多个学科都有各自的分类方案, 但鉴于ISSVA 分类具有前瞻性和实用性,已经在脉管畸形领域长期、广泛使用,故本学组采用ISSVA 分类(2018)方案为本指南分类方案。
第二部分 血管瘤和脉管畸形的发病机制
大多数类型的脉管系统病变是由生殖细胞种系突变和(或)体细胞突变引起的。深入研究血管瘤与脉管畸形相关的遗传学基因突变效应,可更好地理解疾病潜在的分子层面的致病机制,有助于研发新的治疗方法。
1 脉管肿瘤的病因和发病机制
1.1 婴幼儿血管瘤(Infantile hemangioma, IH )
IH主要表现为大量血管内皮细胞增生,其病因及来源尚不清楚,存在多种假说,主要分为两大类:内在的缺陷假设和外部缺陷假设。内在假说为一个或多个内皮细胞增殖相关的基因发生体细胞突变导致肿瘤的形成。这一假说提示血管瘤中的内皮细胞起源于单一十细胞或祖细胞,意味着这些内皮细胞都是克隆增殖而来。在IH组织中可分离出CD133(+)的十细胞,这类细胞拥有多项分化潜能,将这种“血管瘤十细胞”注射到裸鼠体内,可导致裸鼠出现血管瘤样病变,为这一观点提供了支持。2001年,Boye等检测了血管瘤组织中内皮细胞的甲基化表型,发现血管瘤来源的内皮细胞表现出类似的X染色体失活表型,这一发现支持了内皮细胞来源于同一个干/祖细胞的观点。此外,还有一系列研究也提供了相应的证据支持存在体细胞突变。Walter等报道,在血管瘤中检测到血管内皮生长因子受体2 (VEGFR2)的错义突变,而在临近的正常组织中未发现相应突变。与内在缺陷理论相反,外在缺陷理论提示肿瘤微环境造成了血管瘤生成。1999年,Bielenberg等发现,覆盖增生期血管瘤的表皮增生及血管新生增加,然而在消退期血管瘤的临近组织中未观察到类似的现象。这提示增生期血管瘤附近的表皮处可能存在促增殖及抑增殖信号的不平衡,这可能促进了血管瘤的进展。
一种具有内在成分的外在假设也被提出来解释血管瘤的发生。North等发现,血管瘤内皮表达部分胎盘生物学标记物,如GLUT-1,Lewis Y antigen,merosin,Fcy receptor Ⅱ等。其中,GLUT-1被证实在血管瘤内皮细胞中可全程持续高表达直至消退,而在其他良陛血管性肿瘤和血管畸形中不表达,因此提出了胎盘起源假说。Barnes等通过检测表达谱的基因芯片也证实血管瘤和胎盘组织具有较高的相似性。Itinteang等也发现增生期的血管瘤内皮细胞表达人绒毛膜促性腺激素((hCG)和人胎盘催乳素(hPL),支持其来源于胎盘绒毛膜间充质细胞。此外,孕期内的绒毛膜取样可以增加血管瘤的发生率。这些均提示胎盘与血管瘤形成的密切联系。有观点认为,侵入性手术导致胎盘细胞脱落,进入血液循环栓塞在患儿的毛细血管中,而出生后新生儿体内的特殊微环境使其快速增长。
血管内皮细胞生长因子(VEGF)A信号疑是IH形成的关键,因为血管瘤内皮细胞(EC)中VEGF-A信号通路变化会导致IH形成。对参与EC增殖、迁移、豁附或VEGF-A调节的24个基因进行测序,发现整合素样分子肿瘤内皮标志物8 (TEM8)和VEGFR2的种系“风险因子”变异型。TEM8的变异型可以显性一阴性方式起作用,而VEGFR2中的变异型起到功能丧失性改变的作用。突变的TEM8和 VEGFR2在复合体中隔离β整合素,并负向调节β整合素活性和NFAT转录功能,导致VEGFR 1表达降低。
1.2先天性血管瘤(Ccongenital hemangioma,CH)
先天性血管瘤包括3种类型:快速消退型( RICH)、部分消退型(PICH)和不消退型( NICH)。该病与婴幼儿血管瘤的不同之处在于不表达葡萄糖转运蛋白1(GLUT1)。
目前已鉴定出GNAQ和GNA 11的谷氨酞胺209(G1n209)位点的互斥和镶嵌错义突变。GNAQ编码鸟营酸结合蛋白G(q)α,而鸟营酸结合蛋白G(q)α是复合体中的一个可将GTP水解为GDP的亚基。据报道,80%以上的葡萄膜黑色素瘤存在相同的体细胞突变。其中,G1n209错义突变激活GTP依赖性信号,导致MAPI}和(或)YAP信号传导的组成性激活,这些途径也可能参与了RICH和NIGH的形成。
1.3化脓性肉芽肿(Pyogenic granuloma, PG)
PG是一种常见的良性血管肿瘤,继发性PG中存在体细胞GNAQ p.Arg183Gln突变,反映出潜在的CM的细胞来源。另有研究推测BRAF p.Val600Glu突变是孤立性PGs的驱动因素。此外,在结肠癌患者中发现的HRAS突变,也在PG中发挥作用(p .Q61R,p.E49k,Q61R和p.G13S)。 RAS/MAPK信号通路上调可能是PG发生的关键机制。
2 脉管畸形的病因和发病机制
2.1 毛细血管畸形(Capillary malformation , CM )
CM也称葡萄酒色斑(PWS),CM和Sturge-Weber综合征与体细胞GNAQ基因p.Arg183Gln突变有关,这与在先天性血管瘤中发现Gln209突变不同。如在黑色素瘤中所见,GNAQ p.Gln209Leu和GNAQ p.Arg183Gln在转染HEK293T细胞后诱导ERK活化,但对p . Arg183Gln的作用比对p.Gln209Leu温和。
非典型CM患者有时伴有动静脉畸形(Arteri-ovenous malformation,AVM),此类病变称为毛细血管畸形一动静脉畸形(Capillary Malformation-Arteri-ovenous Malformation, CM-AVM )。 CM-AVM是常染色体显性遗传,由RASA1基因种系突变引起,1/3的患者合并高流速脉管畸形。约半数CM-AVM患者可鉴定出RASA1突变,该类病变称为CM-AVMRASA1突变导致功能丧失。在超过100个CM-AVM家族中,报道了超过40个截短突变。根据表型异质性和外显率降低((98%) ,CM-AVM患者中RASA1基因种系突变为前提,在病灶组织细胞的等位基因处出现体细胞突变,使得RASA1基因的一对等位基因完全失活,所造成编码的蛋白质完全缺失。这一“二次打击”理论解释了CM-AVM为何会出现程度不同的高流速脉管畸形。
RASA1编码RAS p21蛋白激活因子1( p120RasGAP ) , p120RasGAP通过增强其较弱的内在GTP酶活性而使RAS失活。p120RasGAP单独或通过膜联蛋白A6募集到受体酪氨酸激酶活化的细胞膜上。p120RasGAP对于EC网络的组织,细胞生长、分化和增殖至关重要。此外,它通过与p190RhoGAP或FAK16的相互作用而参与EC运动。p120RasGAP还通过与AI}T结合,保护细胞免于凋亡。因此,在CM-AVM1患者中,RAS / MAPI}激活时间延长,可导致几种细胞行为的改变。
目前,通过使用全基因组关联性分析,在RASA1基因突变阴性,但临床表现为CM-AVM的患者中,发现了第2种分子分型的CM-AVM病变,称为CM-AVM2。 CM-AVM2由EPHB4基因种系突变所造成的功能丧失突变引起,患者在唇和上胸部周围具有典型的小毛细血管扩张,较少发生脑内快流速病变。
EPHB4是在血管发育过程中优先在静脉EC中表达的跨膜受体,配体EphrinB2也是一种跨膜蛋白,在动脉ECs上表达。EPHB4主要通过RAS/MAPK/ERK1/2途径发挥作用,在与p120RasGAP相互作用时发挥抑制效应,后者是EPHB4的直接效应物。因此,EPHB4(CM-AVM2)或p120RasGAP ( CM-AVM1)的功能丧失具有类似的作用一激活RAS和MAPK/ERK1/2通路。
2.2 遗传性出血性毛细血管扩张症(Hereditary hemorrhagic telangiectasia, HHT)
HHT属于常染色体显性遗传病。有5个位点与HHT有关;已鉴定出的3种基因中,90%的患者至少有1个基因发生突变。HHT1由内皮素((ENG)中的功能丧失突变引起,HHT2由激活素受体样激酶1(ALK1)中的功能丧失突变引起。编码下游效应物SMAD4的MADH4功能缺失突变,导致青少年息肉病/HHT综合征。连锁研究发现,染色体Sq31.3至32(HHT3)和7p14 ( HHT4)的其他突变位点。
这些突变基因都编码参与BMP信号通路的蛋白质。ALK1和内皮素在EC膜上表达受体复合体。内皮素作为共同受体,增加BMP9/BMP10/ALK1信号传导,导致受体磷酸化和R-SMAD1/ 5/8和co-SMAD,SMAD4的激活。它们可作为转录因子,抑制EC迁移和增殖,维持静息内皮状态。此外,人脐静脉内皮细胞中Alk1缺失和BMP9 / 10配体阻断后,VEGF和AKT信号增强。这是由于BMP9/10调节的PTEN活性抑制丧失所引起,可导致不受抑制的PI3K/AKT信号传导。
2.3 静脉畸形
2.3.1 散发性静脉畸形、多灶性静脉畸形、遗传性皮肤豁膜静脉畸形和蓝色橡皮疤痣综合征
静脉畸形(Venous malformation,VM)是临床上最常见的脉管畸形之一,由大小不等的扩张静脉构成,是一种低流速的脉管畸形,随身体的发育呈一定速度的生长,无自愈性,不会自行消退,约40%发生于头、面颈部,其中以口腔领面部及气道内多见。遗传性皮肤豁膜静脉畸形(Hereditary cutaneomucosal venous malformations)非常罕见,患者的临床特征是蓝色瘤体特征性地发生于口腔豁膜,形成突出的蓝紫色瘤体,病变很少累及内脏器官。蓝色橡皮疤痣综合征(Blue rubber bleb nevus syndrome,BRBNS)可累及全身不同部位,主要累及皮肤和消化道。二代基因测序以及分析分型颠覆了以往对VM的认识.开始了VM的系统分子分型以及靶向用药精准治疗进行了有效的探索。2017年,Vikkula等更新以往对于蓝色橡皮泡痣综合征(Blue rubber bleb nevus syn-drome , BRBNS)的遗传性的认识,提出BRBNS是由TEK基因体细胞突变引起的非遗传性疾病,并且将VM分为单一静脉畸形、多发静脉畸形、家族遗传性静脉畸形(Familial VM cutaneo-mucosal,VMCM)以及BRBNS,其基因突变形式分别为TEK(L914F)体细胞突变、TEK(R915C)嵌合突变合并TEK(Y897C)体细胞突变、TEK (R849W)种系突变合并TEK(Y1108*)体细胞突变以及TEK(T1105N -T1106P)
体细胞双突变。VM,VMCM和BRBNS是由编码TEK基因的内皮受体酪氨酸激酶TIE2突变引起的。突变位于细胞内酪氨酸激酶中、激酶插入点或梭基末端尾部,导致氨基酸取代或产生C末端过早终止密码子。在不存在配体的情况下,可诱导TIE2受体磷酸化。
VM中的体细胞激活突变通常作为患者的特征性病变出现,在同一等位基因上是单突变或双突变。L914F是最常见的,且仅在散发性VM中出现。一些散发性患者有多处病变(多灶性VM, MVM)。这些患者往往是第一次突变的镶嵌,紧接着在病变区域产生二次打击。典型的组合是Y897C-R915C。最常见的遗传性VMCM发生的突变是R849W,其导致TIE2弱磷酸化。这需要一个体细胞的二次打击来形成病变,如散发性MVM患者的镶嵌突变。
目前已知3种TIE2配体:血管生成素1(ANGPTl )、血管生成素2 (ANGPT2)和血管生成素4(ANGPT4)。ANGPT1能够激活TIE2,导致受体磷酸化,而ANGPT2是TIE2活性的背景依赖性调节剂。在EC中,配体结合引起TIE2的多聚化及其交叉磷酸化,不仅会引起经典PI3K/AKT途径的激活,也会导致MAPK途径激活。
在VM中,PI3K/AKT/mTOR信号传导似乎是主要的下游信号传导机制。通过鉴定编码磷脂酞肌醇-4,5一二磷酸3一激酶催化亚基α(p110alpha)的PIK3CA突变,更加证实了这一点。p110alpha是PI3K复合体的重要组成部分,存在于半数缺乏TIE2突变的VM中。PIK3CA突变形式的过表达也可激活AKT并破坏特征性的EC单层形态,导致细胞外基质纤维连接蛋白缺失,ANGPT2和PDGF-B表达下调。
BRBN病变还包含TEI}中的点突变,导致受体的配体非依赖性激活。大多数患者具有体细胞TEI}双突变(T1105N-T1106P,Y897F-R915L),并诱导PI3K/AKT信号传导。在BRBN的远中端病变中,鉴定出相同的双突变,尽管在血液中未检测到突变的痕迹。因此,暂时被限制的循环细胞活动,可能参与诱导新病变的形成。
2.3.2 过度角化性皮肤毛细血管静脉畸形
过度角化性皮肤毛细血管静脉畸形(Hyperker-atotic cutaneous cap illary venous malformation,HC-CVM)是与先天性脑海绵状血管畸形(Cerebral cav-ernous malformation,CCM)相关的最常见的皮肤病变,9%的CCM患者会出现皮肤病变。一些患者有皮肤CM,其他有结节型VM。与CCM1一样,具有CCM的HCCVM患者在KRIT1中有先天性功能丧失突变。KRIT1与CCM2和CCM3相互作用,以形成调节MAP3K3功能的复合体。CCM复合功能的丧失,可激活MAP3K3信号传导及其靶基因KLF2 ,KLF4 , RHO和ADAMTS。
2.3.3 疣状静脉畸形
疣状静脉畸形(Verrucous venous malformation)是一种罕见的先天性血管畸形,表现为血管丘疹、斑块或结节,其特征是血管增生和从真皮到皮下组织的扩张,以及表皮的增殖反应。疚状静脉畸形在临床上与HCCVM相似,与MAP3K3中的体细胞激活突变有关,提示其生物学功能障碍类似于HCCVM。MAP3K3是MAP3K家族丝氨酸/苏氨酸激酶的成员,似乎也是血管生成素1/TIE2信号传导的下游靶点,但其与ERK信号传导途径有关。
2.3.4 球细胞静脉畸形(Glomuvenous malformation,GVM)
GVM属于低流量血管畸形,大多为散发,少数为遗传性,为常染色体显性遗传。GVM与散发性VM和VMCM不同,但小的病变在临床上难以区分。肾小球蛋白功能缺失(GLMN / FAP68)导致异常分化的血管平滑肌细胞(vSMCs)出现,称为“血管球细胞”,位于扩张的静脉管腔周围。文献报道了肾小球蛋白超过40种不同的突变。GVM是先天性脉管异常,其中报道的体细胞二次打击数量最多,大多数是体细胞染色体改变(获得性单亲等位基因组),在异质组织中难以鉴定。
肾小球蛋白似乎在EC和vSMC中表达,与未磷酸化的肝细胞生长因子受体c-Met相互作用,但在与配体(肝细胞生长因子)结合后释放,导致肾小球蛋白磷酸化,触发包括p70S6K在内的PI3K下游靶标激活。此外,’肾小球蛋白与Cul7相互作用,形成Skp1-Cul1-Fbox样复合体,通过泛素化作用于蛋白质降解。一些研究表明,肾小球蛋白通过与转化生长因子(TGF)β信号相互作用,改变vSMCs表型。肾小球蛋白与FK506结合蛋白12(FKBP12)结合,通过TGF-βI型受体(TβRI)而抑制TGF-β信号。
2.4 淋巴管畸形(Lymphatic malformation , LM )
淋巴管畸形由体细胞中的PIK3CA突变引起。虽然相同的突变可导致LM和VM,但细胞起源有所不同:淋巴ECs与静脉ECs.PIK3CA突变可增强其与细胞膜的结合和(或)激活其激酶,导致AKT/mTOR级联激活,AKT/mTOR级联调节细胞生长、增殖和迁移。雷帕霉素是mTOR通路的靶点抑制剂,对含有淋巴成分的病灶可能药物反应较好,可成为潜力最大的候选治疗用药。
2.5 动静脉畸形(Arteriovenous malformation,AVM)
动静脉畸形是最危险的脉管异常,表现为红色、温暖、有搏动感的病变。在组织学上,AVM由在动脉化静脉中混合的发育不良动脉和增厚的内膜衬里组成。从AVM培养的内皮细胞显示出活性增加和细胞凋亡减少,表明存在固有的细胞缺陷。AVM形成的遗传学机制目前尚不清楚,已知的是TGF转录信号的紊乱参与了AVM的形成,但仅限于HHT中的AVM。2017年,颅外(体表)动静脉畸形被发现与MAP2K1体细胞突变相关。2018年,颅内动静脉畸形被发现与KRAS基因体细胞突变相关。然而,颅内外动静脉畸形的KRAS基因与MAP2K1基因间的联系及其相互作用.以及CM-AVM与AVM发生之间的联系与相关性,仍未能得到科学的阐述。
第三部分 血管源性肿瘤的诊断和治疗
1、婴幼儿血管瘤
1.1 临床表现
婴儿血管瘤是指由胚胎期间的血管组织增生而形成的,以血管内皮细胞异常增生为特点,发生在皮肤和软组织的良性肿瘤。最早期的皮损表现为充血性、擦伤样或毛细血管扩张性斑片。出生后6 个月为早期增殖期,瘤体迅速增殖,明显隆起皮肤表面,形成草莓样斑块或肿瘤, 大小可达最终面积的80%。之后增殖变缓,6~9 个月为晚期增殖期。节段型血管瘤和深在型血管瘤增殖期可持续至9~12 个月,少数患儿增殖期甚至可持续至出生后24个月。有一小部分瘤体表现为微小增殖或不增殖,主要位于下肢,这部分瘤体应注意与毛细血管畸形区别。90%的患儿在4 岁时瘤体完全消退,瘤体累及越深,消退时间越晚。未经治疗的瘤体消退完成后有25%~69%的患儿残存皮肤及皮下组织退行性改变, 包括瘢痕、萎缩、色素减退、毛细血管扩张和皮肤松弛等。
根据相关文献, 建议将血管瘤分为3 个风险等级(表2)。
表2 血管瘤的风险等级及分级依据
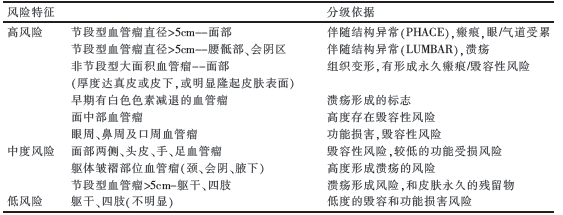
1.2 诊断及鉴别诊断
婴儿血管瘤依病史、临床和影像学可确诊。浅表型婴儿血管瘤早期应与微静脉畸形区别;深在型婴儿血管瘤应与脉管畸形(静脉畸形、动静脉畸形等)区别(表3)。部分婴儿血管瘤需与先天性血管瘤、卡波西型血管内皮瘤等鉴别,通过瘤体生长及消退特征、临床表现及病理检查等可鉴别。深在型血管瘤还应与钙化上皮瘤、皮样囊肿、平滑肌肉瘤、淋巴瘤等鉴别。
表3 婴儿血管瘤与脉管畸形的鉴别诊断
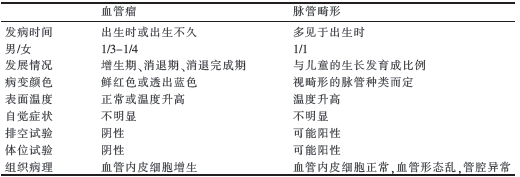
1.3 辅助检查
90%以上的患儿局部B 超检查即可了解瘤体的范围及血供情况,少数位于头皮、骶尾部及重要器官周围的瘤体,需行MRI 检查,以了解是否累及周围组织器官及侵及的程度。位于眼周、耳周等部位的瘤体,需眼科、耳鼻喉科等相关科室会诊,评估眼、耳等器官功能是否受损。巨大或多发的肝脏血管瘤、PHACES 综合征、骶尾部的血管瘤,需行超声心动图检查,以了解有无心功能不全、心脏或主动脉结构异常等。肝脏多发血管瘤, 需行凝血功能及血小板检查,了解有无DIC。全身多发血管瘤,需行甲状腺功能检查,了解有无甲状腺功能低下。
1.4治疗
1.4.1 治疗方法及适应证
婴儿血管瘤主要以局部外用和系统用药为主,辅以激光或局部注射等, 目的是抑制血管内皮细胞增生、促进瘤体消退和减少瘤体残留。①高风险血管瘤:尽早治疗。一线治疗为口服普萘洛尔,若有禁忌证,则系统使用糖皮质激素。②中等风险血管瘤:尽早治疗。早期而菲薄的病灶可给予外用β 受体阻滞剂,也可加用脉冲染料激光;治疗过程中,若不能控制瘤体生长,则遵循高风险血管瘤治疗方案。③低风险血管瘤:如很稳定,可随诊观察,或尝试使用外用药物;如瘤体生长迅速,则遵循中等风险血管瘤治疗方案。④消退期和消退完成期血管瘤的进一步治疗,以唇部血管瘤的整形治疗为例, 最佳年龄是3~4岁,因为之后血管瘤自发改善不再明显。如果推迟治疗,则可能对患儿心理或其他功能造成影响。
1.4.2 治疗方法的选择
1.4.2.1 局部外用药物
适用于浅表型婴幼儿血管瘤的常用药物:①β受体阻滞剂类,如普萘洛尔软膏、噻吗洛尔乳膏、噻吗洛尔滴眼液、卡替洛尔滴眼液等。外涂于瘤体表面,每天2~4 次,持续用药3~6 个月或至瘤体颜色完全消退, 通常用药第2~3 个月时疗效最为明显。除个别报道有变态反应性接触性皮炎外, 还可能有发红、脱屑等局部不良反应。②5%咪喹莫特:隔日夜间睡前薄层外涂于瘤体表面,次日洗去,疗程16 周。常见皮肤反应有红斑、糜烂、溃疡结痂等,发生不良反应时需及时停药,等待皮肤恢复后方可继续用药。由于该药物易引起皮肤强烈的免疫反应, 导致后期皮肤质地改变甚至瘢痕形成,故建议慎用,包括有外用β 受体阻滞剂禁忌证的患儿。
1.4.2.2 局部治疗
①糖皮质激素注射:主要适用于早期、局限性、深在或明显增厚凸起的血管瘤, 治疗终点为病灶体积缩小,甚至接近平坦。在眼周甚至更远区域,偶有报道可能因注射物逆流导致眼动脉及其他动脉栓塞、缺血,从而导致严重并发症。
②博来霉素、平阳霉素及其他抗肿瘤药物注射:用于口服或局部注射糖皮质激素效果不佳时, 为防止偶发的过敏, 建议在注射过程中保持静脉补液通畅。过度治疗可晚期诱发注射区域发育迟缓或障碍。
③局部脉冲染料激光:通常为585 nm 或595 nm脉冲染料激光, 常用于浅表型婴儿血管瘤增殖期抑制瘤体增殖,血管瘤溃疡、消退期后减轻血管瘤的颜色或毛细血管扩张性红斑。该治疗方案并无病灶选择性,对深部病灶无法抑制其生长,以不形成新的皮肤损伤为前提。
1.4.2.3 系统治疗
①普萘洛尔:建议剂量为1.5~2 mg/Kg·d,分2次服用。校正年龄<3 个月的患儿,给予1.5 mg/Kg·d,分2 次服用;校正年龄>3 个月患儿给予2 mg/Kg·d,分2 次服用。使用本药物治疗时要注意适应证,用药前应对患儿进行全面体检,包括心肌酶、血糖、肝肾功能、心电图、心脏彩超、甲状腺功能等。校正年龄2个月以上的患儿治疗可在门诊进行, 由家长对患儿服药后情况进行监测。校正年龄<2 个月的患儿或体重<2 Kg 的低体重儿, 最初服药3 天建议入院严密监测,治疗起始剂量为每天1 mg/Kg,分2 次口服。首次服药后观察患儿有无肢端湿冷、精神萎靡、呼吸困难和明显烦躁等现象。如患儿能够耐受,首次服药12 h 后继续给药,剂量仍为0.5 mg/Kg。如患儿仍然无明显异常,第2 天增量至每天1.5 mg/Kg,分2 次口服,并密切观察。如无异常反应,第3 天增量至每天2 mg/Kg,分2 次口服,后续治疗以此剂量维持。服药期间定期复诊,服药前3 个月应4 周复诊一次,3 个月后可8 周复诊一次,10 个月后可12 周复诊一次。每次复诊应复查生化、心电图、心脏彩超及局部B 超,以评估不良反应及疗效,若出现心肌损害、心功能受损、喘息、低血糖等情况,应对症治疗或由相应科室会诊,在此期间,普萘洛尔剂量应减半,不良反应严重时需停用。口服普萘洛尔瘤治疗婴儿血管瘤无确切停药年龄限制, 瘤体基本消退(临床及B超结果证实)时可考虑停药。大多数患儿服药后瘤体不能达到完全消退, 在瘤体达到最大消退程度超过3 个月且患儿年龄超过1 周岁时, 也可建议其缓慢停药,因为可能会出现停药后复发现象。停药时患儿年龄超过17 月龄以上,则复发风险显著降低。
②糖皮质激素:口服泼尼松3~5 mg/Kg(总量不超过50 mg),隔日早晨1 次顿服,共服药8 周;第9周减量1/2;第10 周,每次服药10 mg;第11 周,每次服药5 mg;第12 周停服,完成1 个疗程。如需继续,可间隔4~6 周后重复上述疗程。该治疗现可用于具有全身用药适应证而不适合于普萘洛尔治疗的病例。用药期间可能有身高、体重和血压等的暂时性影响,应密切监测,服药期间应停止疫苗接种,直至停药后6 周以上。
2 先天性血管瘤
2.1 临床表现
先天性血管瘤(Congenital hemangioma,CH)是一类特殊类型的良性血管瘤。不同于婴幼儿血管瘤,先天性血管瘤在母体子宫内发生发展, 患儿在出生时即有明显病灶。先天性血管瘤区别于婴幼儿血管瘤的另一个特点是其缺乏出生后的增殖期。目前,ISSVA 分类系统中,将已知的先天性血管瘤分3 类:快速消退型CH (Rapidly Involuting Congenital Hemangioma, RICH), 不消退型CH (Non-Involuting Congenital Hemangioma, NICH) 和部分消退型CH(Partially Involuting Congenital Hemangioma, PICH)。不同于婴幼儿血管瘤的女性好发倾向, 先天性血管瘤男女发病率接近1∶1。病灶好发于头面部和肢体,多为单发,偶见多发。绝大多数先天性血管瘤病灶累及皮肤软组织, 完全位于皮下而不累及皮肤者极罕见,亦有发生于肝脏的先天性血管瘤(RICH)。病灶形态多为隆起或斑块状, 边界清楚, 紫红色或蓝紫色,表面有粗细不等的毛细血管分布,周围可见白色的晕环,病灶周围可见放射状分布的浅表扩张静脉。病灶皮温常高于周围皮肤,有时可触及搏动。不同类型的先天性血管瘤出生后呈现各自特征性的临床表现。RICH 在出生后不久即开始快速消退,大约6~14个月时病灶完全消退,残留松弛、菲薄的皮肤,皮下脂肪缺失。在RICH 快速消退过程中可出现并发症,如出血、溃疡等。极少数巨大RICH可因病灶内动静脉瘘造成的动静脉分流而造成心功能衰竭。RICH还可伴发凝血功能障碍,表现为血小板降低、纤维蛋白原降低、D-二聚体升高。NICH在出生时往往与RICH 难以鉴别, 出生后其最显著的特点是病灶随身体等比例生长,既不增殖也不消退。病灶表面皮肤可出现部分苍白, 表面毛细血管往往较RICH更为粗大,病灶周围白色晕环较RICH 更常见。PICH 在出生后先经历类似RICH样的快速消退期, 然而在病灶尚未完全消退时消退中止。消退中止后的残留病灶与NICH 难以区分。因此,有研究认为PICH 的存在是RICH 可转化为NICH的可能证据。目前,三种先天性血管瘤是否是同一起源尚无定论。
2.2 诊断与鉴别诊断
根据典型临床表现和出生后生长行为可诊断大多数先天性血管瘤。依据各自特征性的临床表现不难区分出3 种先天性血管瘤。先天性血管瘤需与婴幼儿血管瘤相鉴别, 先天性血管瘤病灶与婴幼儿血管瘤的前驱病灶在外观上并不相同。在出生时,婴幼儿血管瘤的前驱病灶多表现为皮肤白斑、红点或片状的毛细血管, 而非先天性血管瘤那样显著增大的瘤体。出生后,先天性血管瘤与婴幼儿血管瘤的临床表现完全不同。病理上,先天性血管瘤与婴幼儿血管瘤的小叶结构特点不同。此外,GLUT-1 是鉴别先天性血管瘤与婴幼儿血管瘤的重要标志, 婴幼儿血管瘤小叶内皮细胞均阳性表达, 而先天性血管瘤中为阴性。先天性血管瘤还需与少见的中间性血管瘤(如卡波西型血管内皮瘤)鉴别。卡波西型血管内皮瘤在少数情况下可表现为先天性病灶。所不同的是,在出生后, 多数卡波西型血管内皮瘤呈现进展性临床病程,病灶呈浸润性生长,质地较硬。需要注意的是,以往常将RICH 伴发的凝血功能异常与卡波西型血管内皮瘤和丛状血管内皮瘤伴发的卡梅现象混淆。事实上,RICH 所伴发的凝血功能异常极为少见,而卡梅现象在卡波西型血管内皮瘤中并不少见。RICH伴发的凝血功能异常血小板降低的程度与凝血功能紊乱的严重程度均明显轻于卡梅现象, 且随着瘤体的快速消退,症状逐步缓解;与之相反,卡梅现象症状随卡波西型血管内皮瘤病情进展迅速加重。先天性血管瘤还需与脉管畸形相鉴别。NICH 与动静脉畸形的临床表现有相似性,两者均表现为高流量,病灶皮温均明显增高,NICH 的等比例生长方式也与Ⅰ期动静脉畸形相似。早期文献中有将NICH 诊断为AVM 的先例。然而,动静脉畸形病灶主要由包含动静脉瘘的畸形血管团构成; 而NICH 病灶由大量增殖的内皮细胞和周细胞构成, 是真性的软组织肿瘤,并非真正的动静脉瘘,影像学检查可协助鉴别。先天性血管瘤更需与其他少见的先天性软组织肿瘤鉴别,特别是恶性肿瘤(如软组织肉瘤等),当遇到诊断及鉴别诊断困难时,病理活检是十分重要的手段。
2.3 辅助检查
多普勒超声是重要的辅助检查手段。产前超声检查可最早可在妊娠12 周时检测到先天性血管瘤。然而,受病灶大小、部位、检查者水平和经验限制,并非所有先天性血管瘤均可在子宫内被检测到。出生后超声检查是一种简单、有效的方法。病灶多表现为边界清楚的软组织团块,具有丰富的动静脉血流,可见病灶内扩张的管道样结构。MRI 和CT 可用于进一步检查。MRI 可清楚显示病灶大小、结构、范围以及与周围组织的关系。病灶特点是边界清楚, 呈现T1 低信号,T2 高信号,均匀强化,病灶内的流空影提示高血流量特点。此外,在先天性血管瘤病灶内可发现动脉瘤、血栓及钙化,这在婴幼儿血管瘤中极罕见,有助于鉴别诊断。当需要与动静脉畸形鉴别时,CTA 或DSA 可明确病灶有无动静脉瘘。
2.4 治疗
RICH具有快速消退的特点, 不需要提前治疗干预。治疗主要针对巨大RICH 本身所致或快速消退时所伴发的并发症。巨大RICH 病灶内动静脉瘘造成动静脉分流诱发心功能衰竭, 或出现凝血功能异常时,可先采用药物对症治疗,当药物治疗无法缓解症状, 且症状严重甚至威胁生命时, 供血动脉栓塞, 甚至手术切除病灶是需要考虑的治疗手段。RICH 在消退过程中出现病灶表面溃疡或出血可先采用非手术治疗,压迫止血,保护和处理创面,随着病灶的消退, 症状多可自行缓解, 溃疡自行结痂愈合。包括手术和介入为主的外科治疗在非手术治疗无效或症状进行性加重时方考虑介入。RICH 消退后残留松弛的皮肤和周围扩张静脉,皮下脂肪缺失。此时,治疗的主要目的是改善外观。可采用的方法有手术切除多余皮肤、局部脂肪充填、激光改善肤质、消除扩张静脉。NICH 和PICH 并非都有治疗指征。治疗指征主要包括当病灶位于特殊部位影响功能(如上睑病灶遮挡视野),或病灶影响外观,造成患儿及其家长的心理障碍。手术切除是有效的治疗方式,多数病灶可一期完整切除,术后复发少见。
3 血管内皮瘤
3.1 种类
血管内皮瘤指血管内皮来源的交界性肿瘤,包括卡波西型血管内皮瘤(Kaposiform hemangioendothelioma,KHE)、丛状血管瘤(Tufted angioma,TA)和其他少见血管内皮瘤(混合性血管内皮瘤、网状血管内皮瘤、多形性血管内皮瘤、淋巴管内乳头状血管内皮瘤等)。这一类肿瘤生物学行为介于良、恶性之间,在局部呈侵袭性生长。
3.2 临床表现
3.2.1 KHE与TA
KHE属于交界性血管肿瘤,无远处转移,但具有局部侵袭性,可累及体表多个部位或深部脏器。新生儿中发病率约0.7/1 000 万, 在血管肿瘤中约占2%。绝大多数KHE 病例在1 岁之内发病(90%),其中1 月龄内发病占60%。体表KHE 病灶通常表现为皮肤或皮下坚韧肿物,外观呈紫红色结节或斑块,色泽常深浅不一, 边缘因淤斑或毛细血管扩张而界限不清。自然病程中,婴儿期发病的KHE 常有快速增长期,之后虽有不同程度的缓慢缩小,但不能完全消退。残留病灶性状不一,常呈葡萄酒色斑样改变,皮肤表面散布丘疹及毛细血管扩张, 伴有肿胀和纤维化的质地改变。KHE 和TA 可引起卡梅现象(Kasabach-Merritt phenomenon,KMP), 这是在脉管性疾病基础上伴发血小板减少、微血管溶血性贫血和消耗性凝血功能障碍的一类临床表现, 其病程凶险,患者往往因凝血功能紊乱、败血症以及重要器官的损害而预后不佳。胸腹腔、纵膈、腹膜后的KHE 病灶常累及重要脏器, 血流量较高而极易引发KMP,且发病隐匿,病程凶险,常因呼吸窘迫、腹部膨隆、肌张力减退或便血而就诊。此外,累及肌肉的KHE 病灶同样因为血流丰富而比单纯的皮肤、骨骼病灶更易引发KMP。但就单个病例而言,KHE 病程难以预测, 创伤、感染甚至血制品输注都可能触发瘤体增大、紫癜和疼痛,进而伴发KMP。TA 同样好发于婴幼儿,半数以上在婴儿期发病,近70%在10 岁前发病,且发病越早则自然消退的趋势越明显。增生期通常为5 个月至10 年,此后保持稳定,自发消退仅占10%。TA 的临床症状与KHE 的皮肤病灶类似,但浸润深度浅,也无内脏的累及。因此,体积较大、累及至肌肉的TA 可能引发KM 现象, 病灶可因红肿热痛而被误诊为局部炎症。
3.2.2 Kasabach -Merritt 现象(Kasabach –Merritt phenomenon,KMP)
KMP 是KHE 和TA 特有的重症临床表现,是在脉管性疾病基础上伴发血小板减少、微血管溶血性贫血和消耗性凝血功能障碍的一类临床表现, 其病程凶险,患者往往因凝血功能紊乱、败血症以及重要器官的损害而预后不佳。KMP 的自然病程始于KHE/TA 病灶对血小板的捕获, 外周血中血小板减少,病灶微血管内血小板聚集形成血栓,致使红细胞流经狭窄管腔时被压碎、割裂发生血管内溶血。活化的血小板释放促血管新生介质, 且纤溶系统的相应亢进可造成瘤内出血, 病灶因此快速增大并引起新一轮的凝血物质消耗,最终诱发DIC,重症患儿常因颅内、消化道出血或重要脏器功能衰竭而死亡。
3.3 辅助检查
影像学检查可辅助诊断及鉴别诊断。彩色多普勒超声可检测病灶内血流量, 与其他低流量或高流量脉管畸形相鉴别。增强CT 及MRI 对KHE/TA 诊断亦有价值,CT 平扫表现为均匀或不均匀的低密度灶, 增强呈明显强化。MRI 有利于明确病灶范围,MRI 中T1W1 序列呈等、低信号,T2W1 序列呈等高信号,增强呈不均匀显著强化。实验室检查用于监测KMP 的发生和进展,血小板通常低于50×109 /L。诱发DIC 时, 纤维蛋白原明显降低,PT 和APTT 轻度延长,纤维蛋白降解产物(FDP)或D-二聚体增高,同时有一定程度的微血管病性溶血性贫血。
3.4诊断
特征性的临床表现结合辅助检查可临床诊断部分KHE 与TA 病例。然而,由于交界性肿瘤的生物学性质, 血管内皮瘤的确诊需要严格的组织病理学诊断。KHE 病灶中可见大量形状各异、边界模糊的结节向周围浸润, 边缘伴随着恶性肿瘤中常见的间质反应,结缔组织呈致密的玻璃样变。结节内部形态结合了婴幼儿血管瘤和卡波西肉瘤的特点, 既有成团的梭形内皮细胞,也有高度迂曲、缠绕的微血管,还有大量发育不良的狭缝状管腔,其中充满红细胞,类似卡波西肉瘤。2/3 的病灶中可见畸形的薄壁淋巴管包绕结节并向周围延伸, 少数病灶旁中甚至可见大量的淋巴管增殖,类似淋巴管畸形。此外,病灶中还散布着由圆形透明细胞、含铁血黄素和微小空泡组成的肾小球样结构, 其中可见血小板聚集形成的血栓。结节中内皮细胞表达CD31、CD34、VEGFR-3、D2-40、PROX-1 和FLI1,不表达婴幼儿血管瘤相关抗原表达GLUT-1 和LeY。TA 病灶中的微血管被紧密压缩成小叶状,以炮弹形态分布于真皮网状层,较少浸润至皮下,分布不如KHE 的结节集中,体积也较小。真皮深层的小叶较浅层更大, 并常融合成簇。由于成管不完全,小叶中多种形状(圆形、椭圆和梭形)的内皮细胞以及大量周细胞聚集成团,类似婴幼儿血管瘤。其周围分布的薄壁新月形血管腔和膨大的淋巴管腔也是TA 的特征之一。此外,KHE 病灶中央呈卡波西肉瘤样的微血管在D2-40 染色中为阳性,周围扩张的淋巴管为阴性;TA 则相反,周围扩张的淋巴管在该染色中为阳性, 中央呈炮弹样分布的微血管小叶为阴性。其他少见血管内皮瘤亦有各自特征性的病理表现。
3.5治疗
3.5.1 KHE 与TA
KHE 和TA 的治疗方法包括手术切除、介入栓塞,以及全身用药和血制品等3 类。根据病情进展的轻重缓急,治疗策略大体上可分为三类:①无临床症状,也无增大趋势的体表病灶可密切随访;②有临床症状或增大趋势的体表病灶,以及所有内脏病灶,均需积极治疗。由于可完整切除且不遗留功能毁损的病灶极少见, 因此全身用药应是第一选择;③伴有KMP 的病灶应在积极治疗肿瘤的基础上,酌情应用抗凝药物和血制品,以改善凝血功能。
手术切除通常是肿瘤的首选治疗, 但KHE/TA病灶界限不清,常累及重要血管、神经甚至脏器,极大地增加了手术风险和功能毁损可能。因此,仅少数局限、表浅的病灶可手术完整切除。
介入栓塞可在DSA 辅助下利用药物或材料封堵KHE/TA 的主要滋养血管,暂时缩小病灶,改善凝血功能,为进一步的手术或药物治疗创造条件。由于存在肢体、器官缺血梗死的风险,不推荐在凝血功能恶化的危重病例之外作为首选。
全身用药是目前KHE/TA 治疗的首选, 但众多用药方案的循证医学证据等级普遍较低。近期的大样本临床试验表明, 雷帕霉素的有效性和安全性足以作为一线药物, 且联合糖皮质激素后可显著改善KMP。尽管雷帕霉素与常用一线药物长春新碱的临床对照试验尚未结束,但两者共同作为一线方案,互为备选,无疑是目前较为合理的治疗策略。普萘洛尔已被证实对KMP 效果不佳,不建议单独使用。
雷帕霉素的推荐剂量为0.8 mg/m2(体表面积),每日2 次口服,每月监测血药浓度(10~15 ng/mL),伴发KMP 时联合应用泼尼松龙2 mg/Kg·d 口服或甲强龙1.6 mg/Kg·d 静脉滴注,泼尼松龙、甲强龙和地塞米松之间可按20∶16∶3 的比例换算。雷帕霉素的常见副作用为口腔溃疡、消化、血液和代谢功能的紊乱,通常在减量和停药后可逐步恢复。由于KHE 病例中以婴幼儿患者居多, 在用药过程中务必严格控制血药浓度, 并预防性使用抗生素以预防严重凶险性感染, 如应用复方新诺明以预防卡氏肺孢子菌肺炎等。避免和减轻副作用的关键在于设定合理的治疗目的,即有效控制临床症状,缩小病灶而不是彻底消退。作为非恶性肿瘤,KHE/TA 患儿的“带瘤生存”是常态,尤其是累及肌肉伴发KMP 的病灶在治疗后期常发生致密的纤维化。雷帕霉素连续应用1 年的病例中,后半年的瘤体消退进度明显慢于前半年,因此一旦病灶大小趋于稳定, 症状也没有进一步改善的趋势时,应考虑逐步减量至停药,疗程一般不超过2 年。此外,糖皮质激素在当凝血功能和血小板计数稳定后也应该逐渐减量至停药,通常为6~9周。
长春新碱推荐剂量为0.05 mg/Kg, 每周1 次静脉滴注, 伴发KMP 时联合泼尼松龙2 mg/Kg·d 口服,可在1~3 周内显著改善症状。长春新碱的具体疗程同样取决于症状改善、瘤体缩小与副作用耐受的程度,通常为20~24 周。常见副作用为腹痛、深腱反射缺失与易怒。
KMP 的对症治疗包括抗凝药物和血制品输注。抗凝药物应用于血小板显著减少的病例具有一定争议, 但血小板的聚集活化和释放促血管新生介质是KMP 起始和加重的主因,因此抗血小板药物是对症治疗的重要手段,能够缩短抗肿瘤治疗的疗程。大量针对KMP 的临床研究已证实抗血小板治疗对无活动性出血病例的安全性,并不会增加出血风险,且联合用药效果优于单药治疗。常用方案为阿司匹林和噻氯匹定,其中阿司匹林(2~3 d)抑制环氧酶活性以阻止血小板聚集,噻氯匹定(4~7 d)则可阻断ADP诱导的血小板聚集和血小板释放具有促血管新生作用的α 颗粒。
血制品输注包括血小板、红细胞、血浆、冷沉淀及纤维蛋白原。由于KMP 源于KHE/TA 病灶对血小板的捕获,而非血小板生成障碍,输注的血小板半寿期极短(1~24 h),并可促使瘤体增大、疼痛加重,因此输注血小板仅适用于有明显出血倾向或术前准备的病例。血红蛋白<80 g/L 的贫血患儿需输注红细胞悬液支持治疗。在纠正低纤维蛋白原血症(<1 g/L),尤其是合并活动性出血时, 补充经过病毒灭活的纤维蛋白原浓缩物应首先考虑,其次是冷沉淀输注,最后才考虑输注冰冻血浆, 因为通过血浆补充纤维蛋白原需要较大的用量。
3.5.2其他的少见血管内皮瘤
其他血管内皮瘤治疗相对较棘手,发生率较低,目前尚无治疗共识, 手术治疗被认为是唯一的根治方法。病灶较小者可通过手术完整切除,但手术复发率较高。如无明显增长或并发症,可选择观察随访。
第四部分 脉管畸形的诊断和治疗
1、葡萄酒色斑
1.1 临床表现
葡萄酒色斑(port-wine stains,PWS)为最常见的毛细血管畸形(Capillary malformation,CM),又称鲜红斑痣,系先天性皮肤毛细血管扩张畸形,发病率为0.3%~0.5%,常在出生时出现,好发于头、面、颈部,也可累及四肢和躯干。表现为边缘清楚而不规则的红斑,压之褪色或不完全褪色。红斑颜色常随气温、情绪等因素变化。随着年龄的增长,病灶颜色逐渐加深、增厚,并出现结节样增生。部分严重的病变可伴有软组织和骨组织的增生,导致局部增大变形。可分为3 型:①粉红型,病变区平坦,呈浅粉红至红色,压之完全褪色;②紫红型:病变区平坦,呈浅紫红至深紫红,压之褪色或不完全褪色;③增厚型:病变增厚或有结节增生,压之不完全褪色或不褪色。
1.2 诊断及鉴别诊断
单纯葡萄酒色斑根据病史、临床表现即可诊断。其组织病理学改变为真皮浅层毛细血管网扩张畸形,管壁仍为单层内皮细胞构成,表皮层及其周围组织正常。6 月龄内患儿需与婴儿血管瘤区别,早期两者都可表现为红斑, 但婴儿血管瘤有明确的增生过程,表现为可逐渐隆起且呈鲜红颗粒状,而葡萄酒色斑在幼儿期均呈平坦的红斑,病灶成比例增大。
发生在面部沿三叉神经分布的红斑, 需排除伴有Sturge-Weber 综合征(Sturge-Weber syndrome)。该综合征因病变侵及软脑膜, 有8%的患儿在婴儿期即出现惊厥,因可导致智力障碍和神经功能损害,需神经内科干预。此外,70%的该综合征患儿可出现脉络膜受累,其中30%出现青光眼,早期眼科干预可避免失明。发生在肢体的葡萄酒色斑还需与KT综合征(Klippel-Trénaunay syndrome,KTS)鉴别。KTS有三个临床特点:患肢大面积红斑、先天性静脉(淋巴管)畸形,以及骨和软组织增生肥大。另外,葡萄酒色斑还需要与毛细血管畸形-动静脉畸形(CMAVM)鉴别,后者为家族遗传性,可伴有全身多发的红斑,同时伴有深在的动静脉畸形病灶。
1.3 辅助检查
葡萄酒色斑根据临床表现即可诊断。辅助检查主要用于鉴别综合征。Sturge-Weber 综合征需通过增强MRI 显示软脑膜的异常,还需眼压、眼底检查以筛查青光眼及脉络膜血管畸形。Klippel-Trénaunay综合征的影响主要是皮下组织的增生, 血管造影或MRI 有助于发现深部静脉畸形。CM-AVM 需要行CTA 三维血管成像、增强MRI 或血管造影来确诊AVM病灶。
1.4治疗
1.4.1激光治疗
利用血红蛋白吸收波段(532~1 064 nm)的脉冲激光治疗,是目前葡萄酒色斑的首选治疗方法。需根据患者个体和病情、局部反应等确定治疗参数,剂量过大将导致热损伤和瘢痕。重复治疗需间隔1~2 月。
1.4.1.1脉冲染料激光(Pulsed dye laser,PDL)
常用595 nm PDL,脉宽0.45~20 ms,需要根据光斑大小调节能量密度, 能量密度8~15 J/cm2;或585 nm PDL,脉宽0.45 ms,能量密度5~7 J/cm2;或585~600 nm 可调PDL,脉宽1.5 ms。治疗终点为皮肤即刻出现紫癜。通常使用动态冷却系统或冷风冷却系统来缓解疼痛,及避免热损伤等副作用。
1.4.1.2脉冲倍频Nd:YAG 激光
波长532 nm,脉宽5~30 ms,能量密度7~16 J/cm2。需根据治疗反应由小剂量开始逐步增加, 病灶颜色变暗呈灰紫色即为治疗终点。因532 nm 激光穿透较浅,黑色素吸收较多,色沉较其他波长激光治疗更为常见。
1.4.1.3长脉冲Nd:YAG 激光
波长1 064 nm, 脉宽1~60 ms, 能量密度30~100 J/cm2。因1 064 nm 激光穿透深,可用于增厚病变的治疗。该激光治疗时不易出现紫癜,但瘢痕发生率较其他激光治疗高。
1.4.1.4长脉冲翠绿宝石激光
波长755 nm,可用于增厚病灶,脉宽3~20 ms,治疗后色素沉着和瘢痕发生率较PDL 高。
1.4.2光动力治疗(Photodynamic therapy,PDT)
又称血管靶向光动力疗法(Vascular-target photodynamic therapy,V-PDT),是利用激光激发富集于畸形毛细血管内皮细胞中的光敏剂所产生的单线态氧,选择性地破坏畸形毛细血管网。该方法是继选择性光热作用治疗之后,另一靶向性强、疗效好、安全性佳,且无热损伤的治疗新技术。需根据患者个体和病情,制定个性化方案,主要参数包括光敏药物与剂量,激光参量与治疗量,以及治疗区规划等。
① 光敏药物:如血啉甲醚、血卟啉注射液等。按说明书进行皮试和静注,药量一般为2~5 mg/Kg,给药后即予照光。②治疗光源:首选连续激光,如532 nm半导体激光或全固态激光等,其激发光敏药物效率最高;其次可用高频脉冲激光(准连续激光),如511 nm或578 nm 铜蒸气激光等;再者可用630 nm 半导体激光,其穿透深度更深,但需注意深层正常血管网破坏的风险。用有扩束或光束整形装置的点状光纤,要求光斑大、边界清、光强分布均匀(光强差≤10%)。非激光光源有发光二极管(LED)和强光(IPL)等,LED 波长选择532 nm, 可作为光动力学治疗的光源,但需设定特定的光照距离以保证光源的稳定性,IPL 的激发作用和光束质量远不及激光, 无法经光纤传输,难以准确测量输出光量,使用时需检测照射区的光强度及均匀性。③照光剂量:功率密度即照射强度一般为80~100 mW/cm2。照光时间15~40 min,能量密度即照射光量为60~360 J/cm2。对特殊部位(如鼻翼、上唇、颏部、肢体等)应适当缩短照射时间,儿童患者需适当降低光照的功率密度。④用海姆泊芬后需避强光直射皮肤2~4 周,用血卟啉注射液后约需避光1~3 个月。⑤重复治疗需间隔至少2~4 个月。⑥麻醉:成人患者可局部使用表面麻醉剂或口服/肌注止痛剂,对于不能耐受疼痛的成人患者以及儿童患者可选择在全麻下进行, 减少治疗时的疼痛造成治疗部位的移动。
1.4.3非相干光治疗
强脉冲光治疗(Intense pulsed light,IPL),一般选用560 nm 或590 nm 的滤光片。需根据皮肤类型选择合适的能量密度和脉宽, 同样需避免热损伤导致的瘢痕和疼痛等副作用。
1.4.4手术治疗
对于非手术治疗无效的病例, 可采用手术治疗来清除病灶,或改善外观畸形。
1.4.4.1直接切除缝合
对于病灶较小的葡萄酒色斑, 经多次非手术治疗无效,或既往治疗已形成瘢痕,或病灶已增厚,可考虑一期手术切除后直接缝合。对于切除后拉拢缝合张力较大时,可适当向创缘两侧皮下广泛分离,或延长切口线,动员邻近皮肤组织量,达到一期缝合。
1.4.4.2局部皮瓣
对于按解剖亚单位分布的病灶, 可考虑采用局部皮瓣转位修复,经一期皮瓣转位修复成活后,再行皮瓣修整以达到较好的外观。在皮瓣组织量供区充足的情况下,尽可能一并切除亚单位内正常皮肤,以确保亚单位的完整重建,达到较好的美学效果。
1.4.4.3皮片移植
大面积葡萄酒色斑病灶切除后, 创面采用中厚皮片或全厚皮移植覆盖,是最传统的、简便易行的方法。该方法适用于面部大面积病灶无正常皮肤供区提供修复者、年龄较大的患者,以及自身条件无法耐受其他修复方法的患者。该方法最大的弊端就是术后皮片的颜色和质地无法与受区匹配,尤其是面部,存在明显的色差和面具样外观。
1.4.4.4组织扩张
面部皮肤质地具有特殊性, 其他部位的组织移植后无法重现面部组织的特性。采用组织扩张的方法获取病灶邻近的局部皮瓣或带蒂皮瓣,来修复病灶,能获得与原位组织最接近的修复效果。
1.4.4.5 预构扩张皮瓣
通过单纯组织扩张所获得的扩张皮瓣并不含有轴形血管, 皮瓣转移时将会受到随意皮瓣的血运规律的限制,转移和利用率都将受到很大影响。预构扩张皮瓣的核心是预先在扩张皮瓣内植入知名的血管束,构建轴型皮瓣,改善皮瓣血液供应,可减少皮瓣的坏死率。
1.4.4.6 正畸正颌手术
对于面部葡萄酒色斑合并的上下颌骨轮廓畸形,如骨骼肥大、咬牙合畸形,可联合正畸与正颌手术予以矫正。
2 静脉畸形
2.1 临床表现
静脉畸形(Venous malformation,VM),旧称海绵状血管瘤, 是静脉异常发育产生的静脉血管结构畸形, 病理表现为从毛细血管到腔穴不等的扩张血管腔窦,腔内壁衬以正常的扁平内皮细胞。内皮细胞下为一单层基底膜。血窦的管腔壁平滑肌稀少,外膜纤维变性。静脉畸形通常以单一静脉结构存在,也可与其他血管结构混合, 形成毛细血管静脉畸形或淋静脉畸形等混合畸形。
静脉畸形临床表现不一,从独立的皮肤静脉扩张,或局部海绵状肿块,到累及多组织和器官的混合型。出生时即存在,大部分可以被发现,少部分在幼年或青少年时才被发现。头、颈、颌面为好发部位,四肢、躯干次之。其生长速度与身体生长基本同步,不会自行退化,发病无性别差异。覆盖在静脉畸形上的皮肤可以正常, 如累及皮肤真皮层则表现为蓝色或深蓝色;毛细血管静脉畸形的皮肤为深红色或紫色;淋巴静脉畸形混合型表现为皮肤淋巴小滤泡(常伴有过度角化)。局部为柔软、压缩性、无搏动的包块。包块体积大小可随体位改变或静脉回流快慢而发生变化。如静脉畸形在面颈部者,在低头、屏气或压迫颈浅静脉时充盈增大;小儿表现为哭闹或用力挣扎时膨大;病灶位于四肢者,肢体抬高时病灶缩小,低垂或上止血带时则充盈增大。有时可触及瘤体内有颗粒状静脉石。静脉血栓形成,表现为反复的局部疼痛和触痛, 也可因血液淤滞于扩张静脉腔内造成消耗性凝血病。瘤体逐渐生长增大后,可引起沉重感和隐痛。位于眼睑、口唇、舌、口底、咽壁等部位的瘤体,常影响外观,并可引起相应的视力、吞咽、语音、呼吸等功能障碍;侵及关节腔可引起局部酸痛、屈伸异常。静脉畸形也可只发生于肌肉而不侵入皮肤,如常见的咬肌内静脉畸形。皮下静脉畸形可影响邻近的骨骼变化,在面部多表现为骨骼变形及肥大,而在四肢者多表现为骨骼脱钙和萎缩。淋巴静脉畸形多表现为肥大和变形。
2.2 诊断和辅助检查
由病史及详细的体格检查可以确诊大部分静脉畸形患者,但对于分布不明确的病灶,或为了下一步治疗提供治疗依据,可进行下列检查。①瘤体穿刺:从瘤体中央处穿刺,很容易抽到回血;但是,也无法完全排除非血管而血供十分丰富的疾病产生的包块。②X 线平片:可用于确定瘤体范围及骨质的变化;可确认静脉畸形腔内钙化灶及静脉石。③B 超:病灶表现为明显的液性暗区。该检查主要应用于硬化治疗中的穿刺引导,有助于更加准确穿刺至血窦,特别是深部病灶,或多次治疗后残余的分散血窦。④MRI:由于静脉畸形内有丰富的血液及流动性,MRI加权下能清楚显示静脉畸形的范围, 以及与周围组织紧密的关系,应作为首选的检查项目;同时进行血管增强,可区分是否存在其他非血流液体(如淋巴液等)。其典型影像学特征为在T1 加权像为等信号或低信号, 增强时可见不均匀的强化;T2 加权像表现为明显的高信号,抑脂像更能清晰显示病灶。⑤瘤体造影:有经手背或足背浅静脉穿刺的肢体顺行静脉造影和瘤体直接穿刺造影两种静脉造影方法。顺行静脉造影适合于四肢部位的静脉畸形, 尤其针对于广泛多发性的病例。静脉畸形的静脉造影特征为造影剂进入并潴留在与静脉沟通的异常血窦组织内,后者分隔为多腔,单或多发,形态各异。瘤体与主干静脉之间常有数条引流静脉。但如瘤体过大或瘤体与静脉间的交通过细, 顺行造影常不能充分显示整个瘤体,或造影剂不能进入瘤体使之不显影,此时应选用瘤体直接穿刺的造影法。直接穿刺方法,可确定穿刺的瘤腔大小, 特别可以确认瘤体回流静脉血管与正常主干静脉的关系。另外,若瘤腔间交通不畅,需多点穿刺造影,才能较真实反映病灶情况。⑥选择性动脉造影:可显示瘤体的营养和回流血管,对是否存在动静脉瘘有帮助。因是创伤性检查,需酌情考虑。
2.3 治疗
2.3.1 治疗方法及适应证
静脉畸形可累及任何部位, 但以头颈部最为好发,可导致明显的外观畸形和器官移位;巨大的病灶还可导致面部骨骼发育异常。在肢体和躯干静脉畸形,尤其是弥散型病变中,因血流缓慢淤滞会出现病灶内血栓形成,可引起不同程度的疼痛,甚至功能障碍。因此,对于头面部和伴有疼痛的肢体病灶,应尽早治疗,控制病情进一步发展。
治疗静脉畸形的主要方法是血管内硬化治疗,这是多年发展后的共识。当然,还有其他的非手术和手术方法,可根据畸形的范围、界限、部位单独或联合使用。非手术治疗包括血管内硬化治疗、激光治疗、铜针留置术、电化学及患肢压迫治疗等。手术切除治疗包括单纯手术切除、硬化术后手术切除、热凝及其他治疗后手术,以及相关的修复重建手术。
2.3.2 治疗方法的选择
2.3.2.1 血管内硬化治疗
目前国际主流的治疗方法为血管内硬化治疗(Intravascular sclerotherapy),即通过无水乙醇、博来霉素(平阳霉素)、泡沫硬化剂(聚多卡醇、聚桂醇、十四烷基硫酸钠)或鱼肝油酸钠等硬化剂破坏血管内皮细胞,造成病灶血管的纤维化闭塞和体积的萎缩,实现外观和功能的康复,复发概率较小。但是,广泛而弥散的病灶需多次治疗,而且效果相对较差。
治疗时,从病灶穿刺,回抽见缓慢静脉血流出,治疗在全麻、病灶内局麻或神经阻滞麻醉下进行,要切实保证必要的止痛才可治疗。如非在DSA 下操作,则穿刺点至少两点以上,明确互相流通,才能再进行硬化剂注射, 减少进入动脉或动脉穿支的可能性,以免引发严重并发症。单次治疗,无水乙醇剂量不超过0.2 mL/Kg,聚桂醇单次剂量不超过8 mL,博来霉素总剂量不超过300~400 mg。当瘤体侵及眼眶球后、颈部等很多危险区域时,建议在DSA 下评估治疗的安全性,再行血管内治疗。在多次治疗后因血窦腔缩小致穿刺难度明显增加时,需在B 超引导下精准定位残留病灶,以提高疗效。治疗完毕,穿刺点压迫片刻,局部制动3 d,患部应高于心脏位置以便肿胀消退。
治疗伴随相关并发症,如深部瘤体侵犯肌肉,治疗后可产生短暂性肌肉痛,并较僵硬,1 个月后逐渐恢复正常;如有神经穿过瘤体导致的损伤多为可逆性损伤;如采用平阳霉素治疗可出现过敏性休克,并常在多次治疗后出现;如误入动脉系统可能导致灾难性的组织器官,甚至肢体坏死,即使没有注入动脉内,治疗也可能导致水泡和皮肤坏死。另有血管内治疗后出现心肺危象而导致死亡的报道,其机理不清,需随时警惕。减缓静脉回流是提高疗效,减少并发症的重要措施。
2.3.2.2 手术治疗
静脉畸形病灶内有丰富的腔窦及周围血管,除了部分界限较清楚的局限性异常扩张病灶外, 绝大多数是弥漫且与正常组织界限不清的病灶, 难以手术切除,并对局部组织的功能和形态影响较大,创伤大、出血控制难、复发快、功能和外观影响大。因此,手术不是静脉畸形的首选治疗方法。
手术治疗仅在必要的情况下才使用, 如弥散型的静脉畸形对硬化治疗反应差, 需要手术修复达到外观改善,此类型的巨唇、眼睑臃肿、面部软组织萎缩等都是手术治疗的适应证;对血管内治疗后残留病灶的外观改善、功能重建(如继发跟腱短缩延长等)也需要手术辅助;头面部大范围静脉畸形经过多次过度硬化治疗后,可能导致局部凹陷畸形,或因并发症导致凹陷甚至瘢痕等, 可应用吻合血管或游离的筋膜瓣或筋膜脂肪瓣充填;合并骨骼畸形的患者可以通过截骨和轮廓整形获得良好的美容效果。对于疑难静脉畸形病例,如涉及眼眶内、颅内外沟通或肢体骨骼畸形的VM, 手术也可能是很重要的配合手段之一,成为静脉畸形多学科、序列化、美容性治疗计划的一部分。手术原则应在保存基本功能的情况下, 仔细分离, 保护神经血管肌腱等重要组织结构,进行适当的切除。
2.3.2.3 激光治疗
皮肤或黏膜的浅表静脉畸形可采用激光治疗,分为非侵入性激光治疗和侵入性激光凝固技术,后者又可分为血管腔内激光凝固技术和组织内激光凝固技术。激光治疗体表静脉畸形的理论基础是选择性光热作用, 激光光能被还原型血红蛋白选择性吸收,引起血管腔内血栓形成、血管壁损伤、血管闭合。长脉冲1 064 nm Nd:YAG 激光是治疗浅表静脉畸形的首选,其穿透深度为4~6 mm,能有效作用于浅表病灶。脉宽选择在7~8 ms 时,不会出现明显的血管爆裂和紫癜,能观察到病灶即刻凝固收缩,治疗后局部组织不出现萎缩, 其主要不良反应为色沉、水泡和组织坏死。优化能量、脉宽和脉冲数量的组合,能有效避免上述不良反应,具有较高的安全性。
3 动静脉畸形
3.1 临床表现
动静脉畸形(Arteriovenous malformation,AVM)是一种高流量的先天性血管畸形,由扩张的动脉和静脉组成, 异常的动静脉之间缺乏正常毛细血管床。AVM 发生率低,无性别差异。40%~60%的患者出生时即发现, 易被误诊为毛细血管畸形或血管瘤。头颈部相对好发,其次为四肢、躯干和内脏。病灶局部表现为皮肤红斑,皮温高,可触及搏动或震颤。局部可出现疼痛、溃疡或反复出血,严重者因长期血流动力学异常可致心力衰竭。AVM 还引起外观畸形,重要组织器官受压及功能损害等。AVM 按照疾病进展的严重程度分为4 期(表4)。

3.2 诊断
绝大多数AVM 可通过临床表现明确诊断。和血管瘤不同,AVM 病灶在婴儿期无明显增生变大的病程。AVM 的高流量特征可使之与毛细血管畸形、静脉畸形或淋巴管畸形等区别。
3.3 辅助检查
通过临床表现如不能明确诊断, 可利用影像学检查辅助。彩色多普勒可检测AVM 的高流量特征。MRI 有利于明确病灶范围。DSA 是AVM 诊断的金标准,治疗前需进行DSA 检查,为治疗方案的选择提供指导。如果病灶累及骨骼,则需行CTA 检查。除了疑似恶性肿瘤不能明确诊断的病例, 活检通常不必要,且活检创伤可能引起病灶出血和病情加重。
3.4 治疗
AVM 治疗困难,复发率高。病灶供血动脉结扎或供血动脉近端栓塞,因瘘口未充分处理,通常会加重病情,且不利于后期治疗,这种有害无益的治疗方式应予废弃。AVM 治疗方式包括常规介入栓塞、无水乙醇介入治疗、外科手术、联合治疗等。目前尚无成熟的药物治疗方式。
3.4.1 常规介入栓塞
常规的介入栓塞剂可以是液体, 如NBCA 或Onyx 等, 也可以是固体, 如明胶海绵粉、PVA(Polyvinyl alcohol)及弹簧圈等。因常规栓塞剂不能破坏血管内皮细胞,无法去除AVM 病灶,绝大多数患者最终都会复发,但该治疗可减少术中出血,目前的常规介入栓塞主要用于手术前准备。
3.4.2 无水乙醇介入栓塞治疗
无水乙醇可破坏血管内皮细胞, 是一种效果彻底的治疗方法。但误栓可引起周围正常组织坏死、重要器官功能丧失(如失明), 甚至是心肺衰竭死亡。该治疗必须由经验丰富的专科医师实施,以尽可能减少严重并发症的发生。对于很多颅外AVM,如果能够有效控制并发症率, 无水乙醇介入是颅外AVM 首选的有治愈潜力和高度选择性的一线治疗方法。
3.4.3 外科手术
外科手术在无水乙醇介入栓塞出现以前, 一直是AVM 治疗的主要方法。彻底清除病灶是手术治疗的理想目标。病灶切除后的缺损, 不建议直接植皮,可予局部皮瓣、扩张皮瓣或游离皮瓣修复。彻底的手术切除可实现病灶区域的长期稳定,不再复发,而不完全的切除通常与后期的复发有关。严重的、范围过大和已经导致严重并发症如出血、疼痛或坏死的肢体动静脉畸形,最终需要截肢。无水乙醇介入方法的出现虽然改变了AVM 的治疗模式, 但仍无法完全取代外科手术。
对于无水乙醇介入治疗潜在风险较大的患者,或因病灶难以通过介入途径实现有效治疗, 以及畏惧严重并发症的病例,手术仍是必要的治疗方式。另外,无水乙醇介入栓塞治疗的并发症(如误栓所致的组织坏死),亦需依靠整形手术以改善外观。
3.4.4 联合治疗
无水乙醇介入栓塞技术和外科手术技术,包括器官重建技术、显微外科技术、颌面外科技术、美容外科技术等均熟练掌握的联合治疗团队可有效实现针对同一患者应用多学科技术的联合应用, 实现患者在疗效和安全性方面的利益最大化。
4 淋巴管畸形
淋巴管畸形(Lymphatic malformation,LM),以往称为“淋巴管瘤”,是常见的一种先天性脉管畸形疾病。根据淋巴管囊腔的大小,可将LM 分为巨囊型、微囊型和混合型等三中类型。巨囊型LM 由1 个或多个体积≥2 cm3 的囊腔构成(即以往所称的囊肿型或囊性水瘤),而微囊型LM 则由多个体积<2 cm3 的囊腔构成(即以往的毛细管型和海绵型),二者兼而有之的则称为混合型LM。LM 发病率为1/4 000-1/2000,尚未发现有性别和种族差异。该病多在2 岁前发病,约50%患者出生时即发现罹患此病。LM 可发生在具有淋巴管网的任何身体部位,约75%病变发生在头、颈部,其次为腋窝、纵膈及四肢。
4.1 淋巴管畸形的组织病理和发病机制
LM 的发病机制尚不清楚, 一般认为其病变内皮细胞均可能来源于脉管系统发育的早期。在胚胎期,静脉丛中的中胚层首先形成原始淋巴囊,淋巴囊再逐渐形成有功能的毛细淋巴管, 毛细淋巴管相互吻合成网, 逐渐汇集成一系列由小到大的各级淋巴管。在此过程中, 由于某种原因可使淋巴管系统紊乱, 造成淋巴管非恶性的异常生长和扩张, 即形成LM 组织。其病理学特点:LM 内皮细胞组成的壁薄、形态不规则及大小各异的淋巴管腔内充满淋巴液,周围则有大量的成纤维细胞、白细胞、脂肪细胞和肌细胞等。但是,在LM 的整个病理过程中,无LM 内皮细胞数量的增加,且其形态和功能也表现正常,仅淋巴管管腔直径发生变化。研究发现,淋巴管畸形伴有其他血管畸形或过度发育的综合征中存在体细胞PIK3CA 突变。淋巴管畸形、CLOVES 综合征、FAVA及KT 综合征也称为PIK3CA 相关过度发育疾病谱。
4.2 临床表现及诊断
淋巴管畸形的临床症状多比较典型,结合超声、诊断性穿刺、CT 及磁共振检查, 必要时依据情况辅以活检,基本可以确诊。
淋巴管畸形可以发生在全身任何部位, 其中以主要淋巴系统所在区域最为常见, 因此颈部及腋下发病率最高,腹股沟、纵膈、腹膜后次之,躯干及四肢最低。巨囊型淋巴管畸形通常由不止一个囊腔组成,囊腔之间可相通或不相通。囊腔中含有水样的透明液体,有波动感,有时不透光或呈琥珀色。而微囊型淋巴管畸形的病灶相对较实质性。淋巴管畸形的临床表现受病变的类型、范围和深度的影响而差异很大。有些表现为皮肤黏膜上充满液体的小泡,有些则表现为巨大的肿物。
结合病史和体检怀疑为淋巴管畸形时, 应常规先行超声检查,明确瘤体的部位、性质、大小及与周围组织的关系,为手术或药物注射治疗提供依据,并可用于监测预后情况。MRI(血管增强)检查可提供比较可靠的客观图像并区分淋巴管和血管。深入了解瘤体的位置及与周围组织的关系, 对于颈腋部较复杂位置以及腹盆腔较深位置的瘤体, 在超声不能明确诊断时可用于鉴别诊断,也可辅助诊断性穿刺,若穿刺抽出淡黄色清亮淋巴液即可诊断为淋巴管畸形, 若抽出陈旧性血液结合细胞学检查可诊断为淋巴管瘤伴出血。
4.3治疗
LM 被认为是淋巴系统的良性病变,生长缓慢、很少自然消退。但在遭受创伤、感染及发生囊内出血或不适当治疗后,常突然增大。若LM 生长在特殊部位,则可能导致毁容、畸形、压迫重要器官引起功能障碍,造成长期后遗症,甚至危及患者生命。故对该病需采取积极恰当的干预措施。
以往认为手术是LM 最主要的治疗手段, 但目前LM 的治疗方法多种多样,包括手术切除、激光治疗、硬化剂注射(如注射博来霉素、强力霉素、无水乙醇及OK-432)等。但尚无一种方法可以治疗所有类型的LM。硬化治疗适用于巨囊型和混合型淋巴管畸形,其疗效令人满意;但对微囊型淋巴管畸形则疗效较差。相对于手术治疗,硬化治疗有以下优点:①创伤小,不易损伤重要神经、血管、腺体、肌肉等组织结构;②巨囊型效果良好、治愈率高、不易复发;③操作简便,比较安全;④外形恢复良好,无明显瘢痕。进行硬化剂注射治疗时, 应根据病灶特点, 进行分部位、多次囊腔内注射治疗,避免损伤重要神经、腺体等。一般应抽尽或接近抽尽每个囊腔中的淋巴液,再注入合适剂量与浓度的硬化剂。对于侵犯口底、咽旁、气道周围的病例,为避免治疗后肿胀引起的气道阻塞,治疗前需争取行气管切开术。若气管切开区域有病灶,可先行治疗。目前常用的硬化剂有博来霉素(平阳霉素)、溶血性链球菌制剂OK-432(沙培林)、强力霉素、无水乙醇和泡沫硬化剂等。
手术治疗是过去最主要的, 甚至是唯一的治疗手段,但随着硬化治疗的开展和经验的积累,目前不主张毫无选择地对任何类型的LM 都进行手术切除,只有极少数病例需要在婴幼儿期行手术切除。尽管LM 呈缓慢增大倾向,但并不会侵犯周围组织。局限性大囊型病变可以手术完全切除, 但弥漫性微囊型病变完全切除很困难。目前认可的手术指征:①病灶较小,位置较好,可完全切除;②有症状的微囊型淋巴管畸形;③硬化治疗后仍有症状的巨囊型及混合型淋巴管畸形;④有危及生命的并发症;⑤对外观影响较大。手术切除淋巴管畸形首先需考虑到其良性疾病的性质,保证重要结构的保留。考虑到病灶区重要神经血管的保护, 大多数情况下次全切除或部分切除更为恰当。残留的病灶可通过注射硬化剂进一步治疗。对于头面部淋巴管畸形,巨囊型的舌骨下和舌骨上LM 完全或次全切除的可能性较大, 对于双侧较大病灶并伴有上呼吸道压迫的患者,手术切除应为首选治疗方法。手术必须将单侧或双侧颈部功能性结构解剖清楚,如病灶过大可分期手术。弥漫型的微囊型淋巴管畸形对手术亦是很大的挑战,其病灶浸润周围组织及器官,使解剖结构不清楚,难以分辨其边界。双侧舌骨上伴有上呼吸道压迫的LM只能行部分手术切除, 术后应注意水肿引起的上呼吸道压迫症状。气管切开和放置胃管对于预防压迫发生很重要。联合应用激光、硬化等方法,对于大面积的病灶也很关键。
药物治疗是目前淋巴管畸形治疗研究的热点。目前,最广泛被使用的药物为西罗莫司。西罗莫司又名雷帕霉素,是mTOR (Mammalian target of rapamycin)受体抑制剂。mTOR 在细胞合成分解代谢,细胞运动, 细胞生长及血管生成方面均起到关键的作用。mTOR 通路可以调节做为淋巴管生成和血管生成的关键调节因子VEGF 来影响脉管的生成。根据目前的病例报道及临床实验结果, 建议对于严重的淋巴管畸形, 如GLA、KLA、Gorham-Stout Syndrome及弥漫型淋巴管畸形, 可在患者知情同意下使用。初始剂量为0.1 mg/Kg·d 或0.8 mg/m2·d, 后续调整剂量使血药浓度维持在10~15 ng/mL, 对于婴幼儿患者需同时口服复方新诺明,以预防肺部感染。
第五部分 血管瘤与脉管畸形相关综合征
1、血管瘤相关综合征—PHACE综合征
1.1临床表现
PHACE综合征是一组包含后颅窝畸形(Posteri-or fossa defects)、血管瘤(Hemangiomas)、动脉异常( Arterial anomalies )、心脏畸形和主动脉缩窄(Car-diac defects and coarctation of the aorta)以及眼异常(Eye anomalies)等表现的神经皮肤综合征,以这一系列相关畸形的首字母命名。PHACE综合征被认为没有家族遗传倾向,发病机制尚不完全清楚,或与孕第6}8周的胚胎发育异常有关。该综合征在高加索人种中更为常见,男女发病比例1:9,面部节段型血管瘤是该综合征的特征性表现。根据一项对108例面部节段型大面积血管瘤患儿的前瞻性多中心研究,有31%患儿有PHACE综合征。脑血管异常是该综合征最常见的除皮肤组织外的表现,约有91%的患儿存在,通常发生在面部血管瘤的同侧大脑,主要表现为一侧动脉发育不全或缺失,因脑血管异常引起的中枢神经系统后遗症也是常见的临床表现。其他的皮肤组织以外的表现还包括心血管畸形(37%)、眼异常(16%)、腹侧发育异常(14%)等。
1.2诊断与鉴别诊断
根据PHACE综合征研讨大会于2016年进行的更新,目前诊断共分为2类,即PHACE综合征和疑似PHACE综合征。皮肤组织以外的表现可分为主要和次要诊断标准(表5),当满足节段型面部血管瘤或头面部>5cm直径的血管瘤和1条主要诊断标准或2条次要诊断标准时,即可确诊PHACE综合征;疑似PHACE综合征的诊断需要满足头面部>5cm二直径的血管瘤和1条次要诊断标准。

PHACE综合征患儿在疾病的初期易与Sur}e-Weber综合征混淆,后者是一种以面部葡萄酒色斑、软脑膜和眼脉络膜血管瘤为特征的先天性神经皮肤综合征,随着血管瘤独特的早期快速增生后期缓慢消退的病程,两者的鉴别并不是很难。
1.3辅助检查
当面部节段型血管瘤患儿就诊时,除了常规的全身体检外,还应包括全面而详细的心脏、眼科及神经系统评估。临床检查应包括头颈部检查、气道检查、颅神经检查、颈部触诊排除甲状腺异常、胸骨检查排除胸骨裂和脐上裂。筛查试验包括超声心动图、头部MRI、头颈部MRA、心脏大血管MRA和全面的眼科检查。此外,内分泌相关的血液检查有助于排除甲状腺激素不足的情况。
1.4治疗
由于PHACE综合征是一个多脏器累及的疾病,治疗时,应由整形外科、神经外科、眼科、心脏科等多学科分别对症诊治,但也需要专科医师注意在治疗各自专科疾病时对其他异常器官所可能产生的影响,如当心脏科施行心血管手术治疗时,切勿忽略可能合并的脑血管异常及声门下血管瘤,因前者在术中有可能并发脑血管意外.而后者因影响气道易发生气道梗阻、窒息;当整形外科对面部血管瘤合并脑血管狭窄、发育不良或部分血管瘤缺失的患儿进行口服心得安治疗时,应注意用量,避免心得安可能引起的低血压,进而影响大脑血流灌注,引起神经系统后遗症。目前,已有临床研究证实,口服心得安联合口服激素治疗PHACE综合征患儿,较传统的口服激素治疗更有优势,因其既能减少心得安和激素的用量,又可以增强疗效。
2 脉管畸形相关综合征
2.1 临床表现及诊断
2.1.1 Sturge-Weber综合征
Sturge-Weber综合征((SWS,脑面或脑三叉神经血管瘤病)是因GNAQ体细胞激活突变所致的散发、先天性皮肤神经综合征,发病率为1/20 000-1/50 000,特征是面部葡萄酒色斑,伴有软脑膜血管瘤病和青光眼,癫痛为最常见的神经系统表现,初次发病常在出生后数月内,青光眼可在出生时即存在,也可后天出现。标准化的治疗方案包括葡萄酒色斑的治疗、软脑膜血管瘤病的治疗,以及青光眼的药物或手术治疗。
2.1.2 色素血管性斑痣性错构瘤病
通常指葡萄酒色斑(鲜红斑痣)伴黑素细胞痣或贫血痣,共分5型(表6),最常见的类型是第Ⅱ型。

2.1.3 Klippel-Trenaunay综合征与Parkes-Weher综合征
Klippel-Trenaunay (KT)综合征是由PIK3CA基因突变引起的综合征,目前归类于PIK3CA相关过度生长综合征群(PIK3CA-related overgrowth spec-trum)中,简称PROS,以皮肤毛血管畸形、静脉/淋巴管畸形和软组织及骨肥大等三联征为主要表现,好发于下肢。当存在动静脉畸形时,被称为Klippel-Trenaunay-Weher综合征或Parkes-Weher综合征。
2.1.4 变形综合征
该综合征是一种罕见的散发性疾病,同属于PIK3CA相关过度生长综合征群(PROS),其特点是存在于皮肤、皮下组织、结缔组织、中枢神经系统和内脏等多种组织的发育过度,临床特点为斑片状(镶嵌式)和非对称生长,可以出现各种皮肤和皮下血管畸形,包括毛细血管、静脉和淋巴管畸形,斑片状皮肤发育不良,后者导致皮肤静脉结构突出。
2.1.5 Bannayan-Riley-Ruvalcaba综合征
Bannayan -Riley -Ruvalcaba ( BRR)综合征是一种常染色体显性遗传的多发性错构瘤综合征,由PTEN基因突变造成。BRR综合征的特点是巨头、脂肪瘤、阴茎雀斑样痣和血管畸形。
2.1.6 Cobb综合征
Cobb综合征(皮肤一脊椎脊髓一血管瘤病)是指皮肤血管畸形合并同一节段脊髓血管畸形,表现为伴或不伴有深部血管成分的皮肤毛细血管畸形,有时表面角化过度提示血管角皮瘤。脊髓畸形的神经病学表现包括神经根疼痛、运动障碍、感觉异常和痉挛性麻痹。
2.1.7 Beckwith-Wiedemann综合征
Beckwith -Wiedemann综合征(BWS)是一种遗传性过度发育综合征,主要特点为内脏肥大、巨舌、各种发育缺陷以及新生儿低血糖,是最常见的过度发育综合征。BWS患者面部最常发生毛细血管畸形的区域包括前额正中、眉间和上眼睑。一些患者病变可延伸到鼻和上唇。
2.1.8 Maffucci 综合征
该综合征一种少见的先天性非遗传性疾病,亦属于PIK3CA相关过度生长综合征群,其特点在于多发性内生软骨瘤合并血管畸形。皮肤损害表现多发,为与血管畸形一致的可压缩的红蓝色丘疹和结节。静脉畸形有时伴有血栓形成,X线平片中可见钙化的静脉石。
2.1.9 蓝色橡皮疤样痣综合征
蓝色橡皮疤样痣综合征((BRBNS)是一种罕见的疾病,有报道发现其与巧外显子上的TEK基因发生突变有关,其特点为皮肤和胃肠道静脉畸形。其他内脏器官有时也会受累。诊断的一个特点是可压缩结节,结节压之退缩,留下一个空的皱缩囊,松开后立即恢复原样。
2.1.10 Gorham综合征
Gorham 综合征(Gorham-Stout病,骨消失,消失骨病,大块骨溶解)是一种原因不明的以进行性骨质破坏伴脉管系统增生为特征的罕见疾病。许多患者伴有皮肤血管病变。
2.1.11 CLAPO 综合征
CLAPO综合征(CLAPO syndrome)是一组包含下唇毛细血管畸形(Capillary malformations, CM)、面颈部淋巴管畸形(Lymphatic deformity, LM)和不对称的部分或广泛过度生长的生长症候群。CLAPO综合征于2008年首次提出,因CLAPO综合征中存在PIK3CA的体细胞激活突变,故推测该综合征应属于PIK3CA相关过度生长综合征群。
2.2辅助检查
血管畸形相关综合征这一类疾病辅助检查主要有3个目的:①通过必要的辅助检查,包括基因检测,进一步明确病变累及的血管异常种类及基因突变类型;②通过辅助检查明确病变累及的范围、深度及与周围组织的关系,从而为选择合理的治疗方案提供依据;③通过辅助检查,评估血管病变对周围或全身器官的影响。
B超是首选的检查手段,可大体了解血管异常累及的范围;增强MRI是判断血管病变种类、累及范围的金标准;对于已明确的血管病变,由于治疗原因需进一步了解异常血管的走行.则可局部再行增强CT检查;其他的辅助检查,如心脏彩超、腹部B超、双下肢长骨片、眼科检查、听力检查、脑电图及智力筛查等,则根据病变的部位和范围等综合决定。如Sturge-Weber综合征,需要的辅助检查包括:①眼科测眼压,看眼底;②头颅增强MRI了解颅内是否存在异常血管;③脑电图了解是否存在异常脑电波;④智力筛查了解智力是否受影响。如KT综合征,需要的辅助检查有:①局部B超了解血管异常累及的范围;②局部增强MRI了解皮肤血管及皮下血管异常情况,并了解皮下脂肪、肌肉及骨骼受累程度;③双下肢长骨片了解双下肢是否等长等。
2.3治疗
2.3.1治疗原则
①治疗前需对病情进行充分评估,包括病史、症状、体征及辅助检查,根据评估结果决定患者是需要相对根治治疗、对症姑息治疗或维持现状暂不治疗。②需与患者及家长进行充分沟通,告知疾病的转归、预后及治疗手段本身对疾病的影响,并进行心理辅导,降低对疾病预后的期望值,从而减少由于急于求治的心理而导致过度治疗造成的损害。③评估完成后,选择合适的治疗方法,目的是减少致死率及致残率,而不是根治疾病本身。
2.3.2治疗方法的选择
需根据评估后决定治疗方法。①本病对大部分患者的容貌均有影响,如Sturge-Weber综合征主要位于头面部,对于这些浅表的血管畸形可以进行激光治疗或光动力治疗,以尽可能减少畸形外观对患者造成的心理影响,而且早期治疗对抑制将来血管增生形成的结节样损害有积极的意义。如KT综合征患者,在患者年龄很小时就给予局部束缚治疗,可以减缓两侧肢体不对称的发展速度,一定程度上提高患者的生活质量。②部分患儿存在功能受损,如Sturge-Weber综合征可能出现眼压升高,需进行眼小梁部分切除术.以降低眼压.预防青光眼甚至失明。同时,本病还可能出现癫痛症状,则需口服抗癫痛药物对症治疗。③少数患者可能出现生命威胁,如Sturge-Weber综合征存在脑血管异常时,可能出现脑血管破裂、脑出血等危及生命的风险。对这部分患者要密切监控,交待预后,在进行局部介入、栓塞等治疗无效时,可考虑手术治疗,以解除危及生命的症状或缓解严重的功能障碍。
2.3.3治疗方法
多种治疗方法可供选择。①脉冲染料激光或光动力治疗适用于浅表型血管畸形患者。②局部约束治疗适用于存在肢体过度增长,或双侧肢体不对称的患,需根据年龄调整束缚衣大小。③局部注射治疗适用于病变较局限的深在性损害,常用的药物有博来霉素、聚桂醇、无水乙醇等。④介入或栓塞治疗适用于存在动静脉屡的患者,常用的栓塞剂包括无水乙醇、聚桂醇等。⑤手术治疗主要适用于存在严重功能障碍或生命危险的患者,局部注射或栓塞治疗无效时,可试行手术姑息治疗,以缓解症状或挽救生命。特别需要注意的是,手术治疗的目的不是为了根除病灶。⑥药物治疗:有报道针对PIK3CA相关过度生长综合征群进行口服低剂量的mTOR抑制剂西罗莫司治疗,可减少过度增生,但因注意服药过程中所伴发的不良反应。
第六部分 眶内血管瘤与脉管畸形的诊断和治疗
1、眶内血管瘤的诊断和治疗
1.1眼眶血管瘤临床表现
血管瘤是婴幼儿最常见的眼眶良性肿瘤,绝大多数为后天病变,出生后数周到数月内发病;少数出生后即存在,为先天性病变。其自然病程可分为增生期、消退期和消退完成期。增生期病变生长迅速,大于身体生长速度;约1岁以后肿瘤缓慢消退,进入消退期;5岁时约50%的眼部血管瘤可完全消退;9岁时90%可完全消退。根据病变部位,眼眶血管瘤分为表浅、深部和混合型。表浅血管瘤仅限于皮肤层,主要表现为轻微隆起的鲜红色斑块(旧称草毒痣或毛细血管瘤);深部血管瘤位于眶隔后,表现为眶内的软组织肿块,眼球周围的深部病变可使局部皮下呈青紫色隆起,球后深部病变肉眼不可见,但可推挤眼球使之突出或/和移位。混合型兼有表浅和深部病变特征。表浅血管瘤极少影响功能,深部血管瘤则可因上睑下垂造成视觉剥夺性弱视,或因眼球轴向改变导致散光、斜视,进而形成弱视。肌锥内的血管瘤可直接压迫视神经导致视力下降,但非常罕见。表浅血管瘤较深部病变生长更为迅速,有时可出现局部缺血、坏死、出血。彩色多普勒超声检查示病变血流丰富,为动静脉血混合频谱;磁共振检查显示T1加权像为低信号,T2加权像为高信号,对比增强后明显强化。
1.2 眼眶血管瘤诊断和鉴别诊断
1.2.1 诊断
根据出生后不久发病、生长迅速、鲜红色斑块或青紫色肿块、眼球突出/移位、彩色多普勒超声和磁工振检查等进行诊断。
1.2.2 鉴别诊断
与表浅血管瘤鉴别诊断:①葡萄酒色斑,先天性毛细血管畸形,病变无隆起,生长缓慢,部分患者合并先天性青光眼。②化脓性肉芽肿,有外伤史,青少年多见,皮肤面局限性隆起,质脆、易反复破溃出血。
与深部/混合血管瘤鉴别诊断:①眼眶皮样囊肿或表皮样囊肿,婴幼儿多见,生长缓慢,多表现为眼眶外上方肿块、质地坚韧、边界清楚,皮肤面无颜色改变,CT显示病变内部低密度区,部分病例有局部骨质破坏,对比增强后无明显强化。②横纹肌肉瘤,是好发于儿童的眼眶恶性肿瘤,转移率高,死亡率高。以发展迅速的眼球突出和眶部肿物为最显著的特征。发病年龄较血管瘤晚,好发年龄5一10岁,部分患儿有外伤史,生长迅速,可在数周内造成上睑下垂、结膜水肿、眼球严重突出、移位和视力下降。影像学检查可见骨破坏或病灶内出血。③脉管畸形,包括眼眶静脉畸形、淋巴管畸形以及静脉淋巴混合畸形。
1.3 眼眶血管瘤治疗
1.3.1 治疗适应证
肿瘤位于眼睑,遮挡视轴,压迫眼球,导致形觉剥夺性弱视及散光;肿瘤位于球后,使眼球突出及移位,导致斜视。病变生长迅速,出现坏死、出血、溃疡形成;病变体积大、明显影响外观。
1.3.2 药物治疗
①β受体阻滞剂:是排除哮喘等禁忌证后的首选方法。普蔡洛尔口服,治疗起始剂量1.0m/Kg·d ,分两次口服;第2天增量至每天1.5mg/Kg·d,分2次口服;第3天增量至每天2.0mg/Kg·d,分2次口服;后续治疗以此剂量维持。②糖皮质激素:β受体阻滞剂无效或不能耐受时给予激素治疗。口服泼尼松龙片,2~3mg/Kg·d,用药6-8个月。
1.3.3 手术切除
适用病变范围包括:非手术治疗无效或不耐受,且影响视功能;不消退且明显影响外观。手术根据情况,在保证不损伤视神经、眼外肌等眶内重要结构的前提下,部分或全部切除病灶。
2 眶内血管畸形的诊断和治疗
按照ISSVA分类,根据组织学来源和血液动力学特点,眼眶脉管畸形可以分为低流量和高流量两种类型。
低流量血管畸形包含:静脉畸形(Venous mal-formations , VMs ) ,淋巴管畸形(Lymphatic malforma-dons , LMs ) ,淋巴管静脉混合畸形(Lymphaticovenous malformations , LVs )。静脉畸形分为扩张型静脉畸形(Distensible VM)和非扩张型静脉畸形(Indisten-sible VM)。非扩张型静脉畸形最常见的是眼眶海绵状血管畸形(Cavernous VM,或称Cavernousheman-gioma) 。淋巴管畸形可分为巨囊型淋巴管畸形、微囊型管淋巴畸形和混合巨囊/微囊淋巴管畸形。根据血流动力学特点,淋巴管静脉混合畸形可以分为静脉畸形成分占优势淋巴管静脉混合畸形(静脉淋巴畸形,Venous dominant malformation LVM,VD -LVM)和淋巴管畸形成分占优势淋巴管静脉混合畸形(淋巴静脉畸形,Lymphatic 一 dominant malformation LVM , LD-LVM )。高流量血管畸形包括:动静脉畸形( Arteriovenous malformation , AVM )、先天性动静脉瘘(Congenital arteriovenous fistulas,AVF)。
2.1 临床表现
2.1.1静脉畸形
静脉畸形是最常见的眼眶脉管畸形,主要见于成人。根据病变部位,眼眶静脉畸形分为浅表型、深部型和结合型。浅表型病变位于眼球赤道部前,表现为深紫色的不规则团块;深部型病变位于眼球赤道部后,间接表现为眼球移位或突出度改变。根据病变与眼眶正常静脉系统交通的密集程度,眼眶静脉畸形分为扩张型和非扩张型。扩张型静脉畸形与正常静脉系统广泛交通、血流丰富,在静脉压回流压力增加(如低头、弯腰、Valsalva运动)时,表浅病变扩张增大,深部病变表现为眼球突出度增加,且因眶压增高可伴有疼痛。MRI检查T1加权像低信号,T2加权像中高信号,对比增强后明显强化。出血可在MRI上观察到液平。CT检查可显示病变中的静脉石形成。颈静脉加压后,病变影像学显示范围扩大。值得注意的是,小的扩张型静脉畸形并无Valsalva试验阳性的临床改变,但影像学检查可以鉴定病变的扩张型特征。
眼眶非扩张型静脉畸形为海绵状血管畸形( Cavernous VM ),以往称为海绵状血管瘤(Cav-ernoushemangioma)。海绵状静脉畸形与正常静脉联系较少,可有微小滋养血管,但血流较慢,静脉回流压力增加后病变无明显改变。海绵状静脉畸形多位于肌锥内,以圆形或类圆形病变为主,边界清楚,包膜完整。主要表现为眼球突出、移位,进程缓慢。病变发展到压迫视神经阶段,患者可出现视力下降、视乳头水肿、视野缩小等改变。CT显示包膜完整,边界清晰的类圆形中等密度影,增强呈渐进性强化。病变若侵及眶尖透明三角区,可导致视力下降,与视神经粘连严重,手术风险大,手术预后视力差。MRI检查T1加权像低信号,T2加权像中高信号,对比增强后渐
进性不均匀斑块状强化。
2.1.2混合畸形
组织学上,混合畸形包含静脉和淋巴管成分,根据以静脉成分或淋巴管成分为主,混合畸形分为静脉淋巴畸形或淋巴静脉畸形。静脉淋巴畸形临床上与非扩张静脉畸形临床表现非常接近,往往需要通过术后病理检查才能区分。淋巴静脉畸形(以往称为淋巴管瘤)主要发生于少年儿童,与正常静脉系统无交通或仅有少量交通,病变内部易反复出血,产生液性囊腔,称之为“巧克力囊肿”。患者发生上呼吸道病毒感染时,淋巴静脉畸形可随之加重,并随感染病情缓解而减轻。淋巴静脉畸形对糖皮质激素治疗有效,但仅有暂时性的作用。静脉淋巴混合畸形影像学表现与静脉畸形类似。淋巴静脉混合畸形MRI检查T1加权像低信号,T2加权像高信号,对比增强后仅边缘增强,中央不增强。
2.1.3眼眶动静脉畸形
动静脉畸形在眼眶脉管畸形中所占比例很低,系眼眶动脉血管绕过毛细血管与静脉直接发生沟通,导致静脉血管压力增高,血管迂曲、增粗。根据影响静脉部位的不同,患者可表现为眶周皮肤局部隆起、念珠状或索状弯曲迂回的粗大血管,并伴有搏动,表面温度高于正常皮肤,触之有震颤,听诊可闻及吹风样杂音;球结膜血管迂曲扩张;眼球突出、移位、视力下降等。CT或MRI血管成像可清晰显示病变滋养动脉和回流静脉。数字血管减影(DSA)是诊断的金标准,并可用于引导介入治疗。
2.2诊断和鉴别诊断
2.2.1诊断
眼眶脉管畸形根据年龄、病史、临床表现、影像学检查可明确诊断。
2.2.2鉴别诊断
眼眶脉管畸形诊断包括:与眼眶血管瘤鉴别(见眼眶血管瘤一节)、眼眶脉管畸形之间鉴别(表7)。

2.3治疗
2.3.1 静脉畸形/混合畸形
根据病变类型、部位、血流情况进行个体化综合治疗,一般先给予血管内硬化或激光治疗,以降低病变血流、缩小体积,再给予手术治疗。深部病变的硬化或激光治疗应在CT或M RI成像引导或导航引导下进行。
2.3.1.1扩张型
①表浅病变:翻瓣激光联合手术治疗。②深部肌锥外病变:病灶内激光联合手术治疗。③肌锥内病变:生物胶水硬化联合手术治疗。
2.3.1.2非扩张型/混合畸形
①穿刺有回流的表浅病变:硬化治疗。②穿刺无回流的表浅病变:病变弥散,翻瓣激光联合手术治疗;病变局限,手术治疗。③深部肌锥外病变:先博来霉素(平阳霉素)硬化治疗,无效再手术。④肌锥内病变:博来霉素(平阳霉素)硬化治疗。
2.3.2动静脉畸形
无水乙醇介入治疗是首选方法.必要时可手术治疗(或配以术前DSA引导下的介入栓塞治疗)。

























